Objectivos de aprendizagem
- Definir pressão.
- Aprender as unidades de pressão e como converter entre elas.
A teoria cinética dos gases indica que as partículas de gás estão sempre em movimento e colidem com outras partículas e com as paredes do recipiente que as contém. Embora as colisões com as paredes do recipiente sejam elásticas (ou seja, não há ganho ou perda líquida de energia devido à colisão), uma partícula de gás exerce efectivamente uma força na parede durante a colisão. A acumulação de todas estas forças distribuídas pela área das paredes do contentor provoca algo a que chamamos pressão. A pressão (P) é definida como a força de todas as partículas de gás/colisões da parede dividida pela área da parede:
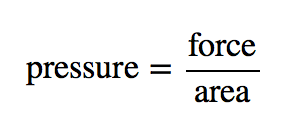
Todos os gases exercem pressão; é uma das quantidades fundamentais mensuráveis desta fase da matéria. Mesmo a nossa atmosfera exerce pressão – neste caso, o gás está a ser “retido” pela gravidade da terra, em vez do gás estar dentro de um recipiente. A pressão da atmosfera é de 101.325 Pa.
A pressão tem uma variedade de unidades. A unidade de pressão formal, aprovada pelo SI, é a pascal (Pa), que é definida como 1 N/m2 (um newton de força sobre uma área de um metro quadrado). No entanto, esta é normalmente demasiado pequena em magnitude para ser útil. Uma unidade comum de pressão é a atmosfera (atm), que foi originalmente definida como a pressão atmosférica média ao nível do mar.
No entanto, a “pressão atmosférica média ao nível do mar” é difícil de identificar devido às variações da pressão atmosférica. Uma unidade mais fiável e comum é o milímetro de mercúrio (mmHg), que é a quantidade de pressão exercida por uma coluna de mercúrio com exactamente 1 mm de altura. Uma unidade equivalente é o torr, que equivale a 1 mmHg (O torr tem o nome de Evangelista Torricelli, um cientista italiano do século XVII que inventou o barómetro de mercúrio). Com estas definições de pressão, a unidade atmosférica é redefinida: 1 atm é definido exactamente como 760 mmHg, ou 760 torr. Temos assim as seguintes equivalências:
1 atm = 760 mmHg = 760 torr
Podemos utilizar estas equivalências como com quaisquer equivalências para realizar conversões de uma unidade para outra. Relacionando-as com a unidade de pressão SI formal, 1 atm = 101.325 Pa.
Exemplo 1
Quantas atmosferas existem em 595 torr?
Solução
Usando as equivalências de pressão, construímos um factor de conversão entre torr e atmosferas: 1 atm = 760 torr. Assim,

Porque os números no factor de conversão são exactos, o número de números significativos na resposta final é determinado pelo valor inicial da pressão.
Teste-te
Quantas atmosferas existem em 1.022 torr?
Resposta
1,345 atm
Exemplo 2
Atmosfera em Marte é em grande parte CO2 a uma pressão de 6,01 mmHg. Qual é esta pressão em atmosferas?
Solução
Utilizar as equivalentes de pressão para construir o factor de conversão adequado entre milímetros de mercúrio e atmosferas.
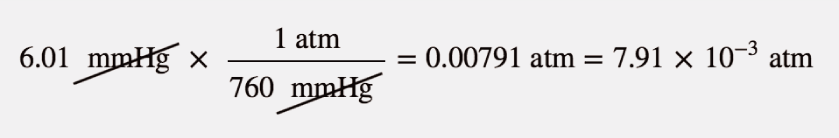
No final, exprimimos a resposta em notação científica.
Teste-te a ti próprio
A pressão atmosférica é baixa no olho de um furacão. Num furacão de 1979 no Oceano Pacífico, foi relatada uma pressão de 0,859 atm dentro do olho. Qual é esta pressão em torr?
Resposta
652 torr
Key Takeaways
- Pressão é uma força exercida sobre uma área.
- A pressão tem várias unidades comuns que podem ser convertidas.
Exercícios
-
p>>Definir pressão. O que a causa?
Definir e relacionar três unidades de pressão.
- li>
se uma força de 16.7 N é pressionado contra uma área de 2,44 m2, qual é a pressão em pascal?
Se uma força de 2,546 N for pressionada contra uma área de 0.0332 m2, qual é a pressão em pascals?
Explicar porque é que a definição original de atmosfera não funcionava bem.
>li>
Que unidades de pressão são iguais entre si?
p> Quantas atmosferas existem em 889 mmHg?
Quantas atmosferas estão em 223 torr?
p> Quantas torr estão em 2.443 atm?Quantos milímetros de mercúrio estão em 0,334 atm?
- >div>
Quantos milímetros de mercúrio estão em 334 torr?
Quantos torr estão em 0,777 mmHg?
- >li>
Quantos pascóis estão em 1 torr?
Uma pressão de 0,887 atm é igual a quantos pascos?
Respostas
Pressão é força por unidade de área. É causada por partículas de gás que atingem as paredes do seu recipiente.
p>6.84 Pa
Porque a pressão atmosférica ao nível do mar é variável, não é uma unidade consistente de pressão.
1.17 atm
1.857 torr
334 mmHg
133 Pa