Objectivos de aprendizagem
- Aprenda os termos básicos utilizados para descrever a matéria.
A definição de química – o estudo das interacções da matéria com outra matéria e com a energia – utiliza alguns termos que também devem ser definidos. Iniciamos o estudo da química definindo alguns termos básicos.
Matéria. Um livro é matéria, um computador é matéria, comida é matéria, e sujidade no solo é matéria. Por vezes, a matéria pode ser difícil de identificar. Por exemplo, ar é matéria, mas por ser tão fino em comparação com outra matéria (por exemplo, um livro, um computador, comida, e sujidade), esquecemo-nos por vezes que o ar tem massa e ocupa espaço. As coisas que não são matéria incluem pensamentos, ideias, emoções, e esperanças.
Exemplo 1
Qual das seguintes coisas é matéria e não matéria?
- um cachorro-quente
- amor
- uma árvore
Solução
- Um cachorro-quente tem massa e ocupa espaço, por isso é matéria.
- O amor é uma emoção, e as emoções não são matéria.
- Uma árvore tem massa e ocupa espaço, por isso é matéria.
- a lua
- uma ideia para uma nova invenção
- A lua é matéria.
- A própria invenção pode ser matéria, mas a ideia para ela não é.
Teste-te a ti mesmo
Qual dos seguintes é matéria e não matéria?
Resposta
Figura 1.1 As Fases da Matéria

“Ice cubes” de Darren Hester está licenciado sob a Creative Commons Attribution-Share Alike 2.5 Generic; “Glass of Water” de Greg Riegler está licenciado sob a Creative Commons Attribution 2.0 Genéricos; Tea Time by Vélocia está licenciado sob a Creative Commons Attribution-NonCommercial- NoDerivs 2.0 Generic.
Para compreender a matéria e como ela muda, precisamos de ser capazes de descrever a matéria. Há duas formas básicas de descrever a matéria: propriedades físicas e propriedades químicas. As propriedades físicas são características que descrevem a matéria tal como ela existe. Algumas das muitas características físicas da matéria são forma, cor, tamanho, e temperatura. Uma propriedade física importante é a fase (ou estado) da matéria. As três fases fundamentais da matéria são: sólida, líquida e gasosa (ver Figura 1.1 “As Fases da Matéria”).
Figura 1.2 Propriedades Químicas
O facto de esta fósforo queimar é uma propriedade química da fósforo.

“acender um fósforo” (http://commons.wikimedia.org/wiki/File:Match_stick,_lit_a_match,_match_box,_fire.JPG) por Jith JR está licenciado sob a Creative Commons Attribution-Share Alike 3.0 Unported.
As propriedades químicas são características da matéria que descrevem como a matéria muda de forma na presença de outra matéria. Será que uma amostra de matéria queima? A queima é uma propriedade química. Comporta-se de forma violenta quando é colocada em água? Esta reacção é também uma propriedade química (Figura 1.2 “Propriedades Químicas”). Nos capítulos seguintes, veremos como as descrições das propriedades físicas e químicas são aspectos importantes da química.
Figure 1.3 Alterações físicas
O gelo sólido funde em água líquida – uma alteração física.

“derreter cubos de gelo” (https://www.flickr.com/photos/jariceiii/5012344135/) by Jar é licenciado sob Creative Commons Attribution 2.0 Generic.
Se a matéria ficasse sempre na mesma, a química seria bastante aborrecida. Felizmente, uma parte importante da química envolve mudanças. Uma mudança física ocorre quando uma amostra de matéria muda uma ou mais das suas propriedades físicas. Por exemplo, um sólido pode derreter (Figura 1.3 “Alterações Físicas”), ou o álcool num termómetro pode mudar de volume à medida que a temperatura muda. Uma alteração física não afecta a composição química da matéria.
Uma alteração química é o processo de demonstração de uma propriedade química, tal como o fósforo de queima na Figura 1.2 “Propriedades Químicas”. Como a matéria no fósforo arde, a sua composição química muda, e são criadas novas formas de matéria com novas propriedades físicas. Note-se que as alterações químicas são frequentemente acompanhadas de alterações físicas, uma vez que a nova matéria terá provavelmente propriedades físicas diferentes da matéria original.
Exemplo 2
Descrever cada processo como uma alteração física ou uma alteração química.
- A água no ar transforma-se em neve.
- O cabelo de uma pessoa é cortado.
>li>A massa de pão torna-se pão fresco num forno.
Solução
- Por causa da temperatura do forno, estão a ocorrer alterações químicas na massa de pão para fazer pão fresco. Estas são alterações químicas. (De facto, muita cozedura envolve alterações químicas.)
- Um fogo está a arder numa lareira.
- A água é aquecida para fazer uma chávena de café.
- mudança química
- mudança física
- li>Porque a água está a passar de uma fase gasosa para uma fase sólida, isto é uma mudança física.li>O seu cabelo comprido está a ser encurtado. Isto é uma alteração física.
Test Yourself
Identificar cada processo como uma alteração física ou uma alteração química.
Respostas
Uma amostra de matéria que tem as mesmas propriedades físicas e químicas em todo o processo é chamada substância. Por vezes é utilizada a frase substância pura, mas a palavra pura não é necessária. A definição do termo substância é um exemplo de como a química tem uma definição específica para uma palavra que é utilizada na linguagem quotidiana com uma definição diferente e mais vaga. Aqui, utilizaremos o termo substância com a sua definição química rigorosa.
A química reconhece dois tipos diferentes de substâncias: elementos e compostos. Um elemento é o tipo mais simples de substância química; não pode ser decomposto em substâncias químicas mais simples por meios químicos comuns. Existem cerca de 115 elementos conhecidos pela ciência, dos quais 80 são estáveis. (Os outros elementos são radioactivos, uma condição que iremos considerar no Capítulo 15 “Química Nuclear”). Cada elemento tem o seu próprio conjunto único de propriedades físicas e químicas. Exemplos de elementos incluem ferro, carbono, e ouro.
Um composto é uma combinação de mais do que um elemento. As propriedades físicas e químicas de um composto são diferentes das propriedades físicas e químicas dos seus elementos constituintes; ou seja, comporta-se como uma substância completamente diferente. Existem mais de 50 milhões de compostos conhecidos, e mais estão a ser descobertos diariamente. Exemplos de compostos incluem água, penicilina, e cloreto de sódio (o nome químico para sal de mesa comum).
Elementos e compostos não são as únicas formas em que a matéria pode estar presente. Encontramos frequentemente objectos que são combinações físicas de mais do que um elemento ou composto. As combinações físicas de mais do que uma substância são chamadas misturas. Existem dois tipos de misturas. Uma mistura heterogénea é uma mistura composta de duas ou mais substâncias. É fácil dizer, por vezes a olho nu, que está presente mais do que uma substância. Uma mistura homogénea é uma combinação de duas ou mais substâncias que é tão intimamente misturada que a mistura se comporta como uma única substância. Outra palavra para uma mistura homogénea é solução. Assim, uma combinação de sal e palha de aço é uma mistura heterogénea porque é fácil ver quais as partículas da matéria que são cristais de sal e quais as que são palha de aço. Por outro lado, se pegarmos nos cristais de sal e os dissolvermos em água, é muito difícil dizer que temos mais do que uma substância presente apenas por olhar – mesmo que utilizemos um microscópio potente. O sal dissolvido em água é uma mistura homogénea, ou uma solução (Figura 1.4 “Tipos de Misturas”).
Figure 1.4 Tipos de Misturas
 À esquerda, a combinação de duas substâncias é uma mistura heterogénea porque as partículas dos dois componentes têm um aspecto diferente. À direita, os cristais de sal dissolveram-se na água tão finamente que não se pode dizer que o sal está presente. A mistura homogénea aparece como uma única substância. A “mistura de farinha e cacau” de Jessica e Lon Binder está licenciada sob Creative Commons Attribution-NonCommercial-NoDerivs 2.0 Generic; “um copo de água” de Bryan está licenciado sob Creative Commons Attribution-NoDerivs 2.0 Genéricos.
À esquerda, a combinação de duas substâncias é uma mistura heterogénea porque as partículas dos dois componentes têm um aspecto diferente. À direita, os cristais de sal dissolveram-se na água tão finamente que não se pode dizer que o sal está presente. A mistura homogénea aparece como uma única substância. A “mistura de farinha e cacau” de Jessica e Lon Binder está licenciada sob Creative Commons Attribution-NonCommercial-NoDerivs 2.0 Generic; “um copo de água” de Bryan está licenciado sob Creative Commons Attribution-NoDerivs 2.0 Genéricos.Exemplo 3
Identificar as seguintes combinações como misturas heterogéneas ou misturas homogéneas.
- água com soda (O dióxido de carbono é dissolvido na água.)
- uma mistura de limalhas metálicas de ferro e enxofre em pó (Tanto o ferro como o enxofre são elementos.)
Solução
- Porque o dióxido de carbono é dissolvido na água, podemos inferir a partir do comportamento dos cristais de sal dissolvidos na água que o dióxido de carbono dissolvido na água é (também) uma mistura homogénea.
- Assumindo que o ferro e o enxofre são simplesmente misturados, deve ser fácil ver o que é ferro e o que é enxofre, por isso esta é uma mistura heterogénea.
Test Yourself
As seguintes combinações são misturas homogéneas ou misturas heterogéneas?
- o corpo humano
- uma amálgama, uma combinação de alguns outros metais dissolvidos numa pequena quantidade de mercúrio
Respostas
- mistura heterogénea
- mistura homogénea
Existem outros descritores que podemos utilizar para descrever a matéria, especialmente elementos. Podemos normalmente dividir elementos em metais e não metais, e cada conjunto partilha certas (mas nem sempre todas) propriedades. Um metal é um elemento que é sólido à temperatura ambiente (embora o mercúrio seja uma excepção bem conhecida), é brilhante e prateado, conduz bem electricidade e calor, pode ser esmagado em folhas finas (uma propriedade chamada maleabilidade), e pode ser arrastado em fios finos (uma propriedade chamada ductilidade). Um não-metal é um elemento frágil quando sólido, não conduz electricidade ou calor muito bem, e não pode ser transformado em folhas finas ou fios (Figura 1.5 “Semimetálicos”). Os não metálicos também existem numa variedade de fases e cores à temperatura ambiente. Alguns elementos têm propriedades tanto de metais como de não metais e são chamados de semimetálicos (ou metalóides). Veremos mais tarde como estas descrições podem ser facilmente atribuídas a vários elementos.
Figure 1.5 Semimetals

“Pouring liquid mercury bionerd” é licenciado sob a Creative CommonsAttribution 3.0 Unported; “Sulphur-vulcano” de Heidi Soosalu é licenciado sob a Creative Commons Attribution-Share Alike 3.0 Unported.
Figure 1.6 “Descrevendo a Matéria” é um fluxograma das relações entre as diferentes formas de descrever a matéria.
Figure 1.6 Descrevendo a Matéria
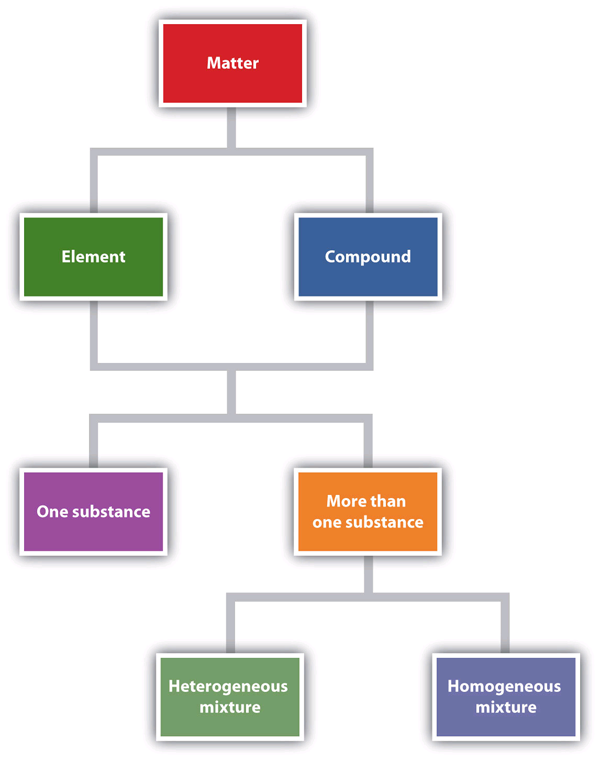
Este fluxograma mostra como a matéria pode ser descrita.
A química está em todo o lado: De manhã
A maioria das pessoas tem um ritual matinal, um processo pelo qual passam todas as manhãs para se prepararem para o dia. A química aparece em muitas destas actividades.
- Se tomar um duche ou um banho de manhã, provavelmente usa sabonete, champô, ou ambos. Estes artigos contêm químicos que interagem com o óleo e a sujidade do seu corpo e cabelo para os remover e lavar. Muitos destes produtos também contêm químicos que lhe conferem bom cheiro; chamam-se fragrâncias.
- Talvez tome vitaminas, suplementos, ou medicamentos todas as manhãs. As vitaminas e outros suplementos contêm substâncias químicas de que o seu corpo necessita em pequenas quantidades para funcionar correctamente. Os medicamentos são químicos que ajudam a combater doenças e a promover a saúde.
- Talvez faça alguns ovos fritos para o pequeno-almoço. Fritar ovos envolve aquecê-los o suficiente para que ocorra uma reacção química para cozinhar os ovos.
- Depois de comer, a comida no seu estômago reage quimicamente para que o corpo (principalmente os intestinos) possa absorver alimentos, água e outros nutrientes.
- Se conduzir ou apanhar o autocarro para a escola ou para o trabalho, está a utilizar um veículo que provavelmente queima gasolina, um material que queima com bastante facilidade e fornece energia para alimentar o veículo. Lembre-se de que queimar é uma mudança química.
li> Quando escova os dentes de manhã, normalmente usa pasta de dentes, uma forma de sabão, para limpar os dentes. As pastas de dentes contêm normalmente pequenas partículas duras chamadas abrasivos que esfregam fisicamente os seus dentes. Muitas pastas de dentes também contêm flúor, uma substância que interage quimicamente com a superfície dos dentes para ajudar a prevenir cáries.
Estes são apenas alguns exemplos de como a química tem impacto na sua vida quotidiana. E ainda nem sequer chegámos a almoçar!
Figure 1.7 Chemistry in Real Life

“Sabonetes e Champôs” de Takashi Ota está licenciado sob Creative Commons Attribution 2.0 Genérico; “English Breakfast” está licenciado sob a Creative Commons Attribution-Share Alike 3.0 Unported; “Langley, Trans-Canada Highway” de James está licenciado sob a Creative Commons Attribution- Share Alike 3.0 Unported.

Fonte de vídeo: O mundo químico por keyj (https://viuvideos.viu.ca/media/The+Chemical+World/0_ixlxmwe8)
Key Takeaways
- Chemistry is the study of matter and its interactions with other matter and energy.
- Matéria é tudo o que tem massa e ocupa espaço.
- Matéria pode ser descrita em termos de propriedades físicas e propriedades químicas.
- As propriedades físicas e químicas da matéria podem mudar.
- Matéria é composta por elementos e compostos.
- Combinações de diferentes substâncias são chamadas misturas.
- Elementos podem ser descritos como metais, não metais, e semimetálicos.
Exercícios
- Identificar cada um como matéria ou não matéria.
a) um livro
b) ódio
c) luz
d) um carro
e) um ovo frito
2. Dar um exemplo de matéria em cada fase: sólida, líquida, ou gasosa.
3. Cada afirmação representa uma propriedade física ou uma propriedade química?
a) o enxofre é amarelo.
b) a lã de aço queima quando inflamada por uma chama.
c) Um galão de leite pesa mais de oito libras.
4. Cada afirmação representa uma propriedade física ou uma propriedade química?
a) Uma pilha de folhas apodrece lentamente no quintal.
b) Na presença de oxigénio, o hidrogénio pode interagir para fazer água.
c) O ouro pode ser esticado em fios muito finos.
5. Cada afirmação representa uma mudança física ou química?
a) A água ferve e torna-se vapor.
b) Os alimentos são convertidos em forma utilizável pelo sistema digestivo.
c) O álcool em muitos termómetros congela a cerca de -40 graus Fahrenheit.
6. Cada afirmação representa uma mudança física ou química?
a) A grafite, uma forma de carbono elementar, pode ser transformada em diamante, outra forma de carbono, a temperaturas e pressões muito elevadas.
b) A casa do outro lado da rua foi pintada com uma nova cor.
c) Os elementos sódio e cloro juntam-se para fazer uma nova substância chamada cloreto de sódio.
7. Distinguir entre um elemento e um composto. Sobre quantos de cada um são conhecidos?
8. Qual é a diferença entre uma mistura homogénea e uma mistura heterogénea?
9. Identificar cada um como uma mistura heterogénea ou uma mistura homogénea.
a) O sal é misturado com pimenta.
b) O açúcar é dissolvido em água.
c) A massa é cozida em água a ferver.
10. Identificar cada um como uma mistura heterogénea ou uma mistura homogénea.
a) ar
b) sujidade
c) um aparelho de televisão
11. No Exercício 9, que escolhas são também soluções?
12. No Exercício 10, que escolhas são também soluções?
13. Porque é que o ferro é considerado um metal?
14. Porque é que o oxigénio é considerado um não metal?
15. Distinguir entre um metal e um não-metal?
16. Que propriedades têm os semimetálicos?
17. O carbono elementar é um sólido preto, de aspecto baço, que conduz bem o calor e a electricidade. É muito frágil e não pode ser transformado em folhas finas ou fios longos. Destas propriedades, como é que o carbono se comporta como um metal? Como é que o carbono se comporta como um não-metal?
18. O silício puro é brilhante e prateado, mas não conduz bem a electricidade ou o calor. Destas propriedades, como é que o silício se comporta como metal? Como é que o silício se comporta como um não metal?
p>Respostas
a) matéria
b) não matéria
c) não matéria
d) matéria
a) propriedade física
b) química propriedade
c) propriedade física
a) alteração física
b) alteração química
c) alteração física
7. Um elemento é uma parte química fundamental de uma substância; existem cerca de 115 elementos conhecidos. Um composto é uma combinação de elementos que actua como uma substância diferente; existem mais de 50 milhões de substâncias conhecidas.
a) heterogéneo
b) homogéneo
c) heterogéneo
11. A escolha b é uma solução.
13. O ferro é um metal porque é sólido, é brilhante, e conduz bem a electricidade e o calor.
15. Os metais são tipicamente brilhantes, conduzem bem a electricidade e o calor, e são maleáveis e dúcteis; os não metálicos são uma variedade de cores e fases, são frágeis na fase sólida, e não conduzem bem o calor ou a electricidade.
17. O carbono comporta-se como um metal, porque conduz bem o calor e a electricidade. É um não-metal porque é preto e frágil e não pode ser transformado em folhas ou fios.