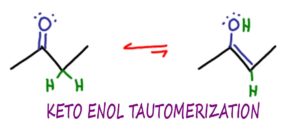
 Tautomerização Keto Enol ou KET, é uma reacção química orgânica na qual moléculas de cetona e enol podem isomerizar ou interconverter, tipicamente numa reacção catalítica ácida ou de base.
Tautomerização Keto Enol ou KET, é uma reacção química orgânica na qual moléculas de cetona e enol podem isomerizar ou interconverter, tipicamente numa reacção catalítica ácida ou de base.
Keto Enol Tautomerization aparecerá algumas vezes no seu curso de química orgânica, começando com reacções de hidratação alquídica, e voltando a aparecer nas suas reacções avançadas (orgo 2) de enolamento e condensação.
Tautomerização é um tipo muito específico de isomerização,
neste caso a interconversão entre as formas keto e enol de uma molécula.
p>
Keto refere-se ao grupo funcional das cetonas – embora KET não se limite apenas às cetonas.
Aldeídos, que são muito semelhantes às cetonas,
exceto para um hidrogénio terminal,
pode também sofrer uma tautomerização.
p> Enol vem de ‘Ene’ como em alkene,
Enol vem de ‘Ene’ como em alkene,
a carbon to carbon double bond.
e ‘ol’ como em álcool – um grupo OH.
p>Feeling rusty? Rever os Grupos Funcionais da Química Orgânica
Se a tautomerização é como a isomerização,
Pense em tautómeros como isómeros, especificamente isómeros constitucionais.
O termo Tautómeros refere-se às duas formas específicas da molécula que se podem interconverter em equilíbrio.
Em KET, as formas Keto e Enol são tautómeros uma da outra.

WhWhicher Mais Estável, Keto ou Enol?
Apesar de ser uma reacção reversível, a forma keto é mais estável e assim favorecida pelo equilíbrio.
Isto porque o carbono duplamente ligado ao oxigénio é mais estável do que um simples carbono ligado ao oxigénio e um simples ligado ao hidrogénio.
Felizmente, esta matemática é da termodinâmica coberta em química geral e algo que não é necessário calcular ao nível da química orgânica (embora alguns professores ainda o exijam).
Esta não é uma regra difícil e rápida.
Existem algumas situações em que a forma enol proporcionará maior estabilidade à molécula em geral. Veja o exemplo abaixo:

A forma keto tem um carbonilo mais estável, mas a forma enol permite que a ligação pi faça parte de um sistema aromático muito mais estável (reveja aqui a aromaticidade). Portanto, a forma de enol desta molécula predominará em equilíbrio.
Keto Enol Tautomerização surgirá em várias reacções orgânicas, começando com a hidroboração e a oximerização de alcinos.
KET em Oxymercuration of Alkynes
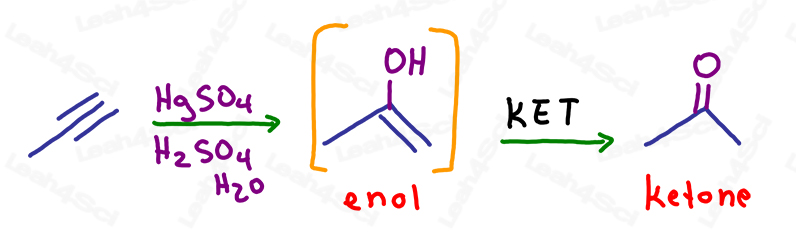
As com alcenos, a reacção de oxymercuration simplesmente quebra UMA ligação de pi para adicionar um álcool ao carbono mais substituído, seguindo a regra de Markovnikov.
A molécula resultante ainda tem uma ligação pi: um alqueno no mesmo carbono que o álcool.
Este é um enol instável e será automaticamente submetido a uma tautomerização keto enol para formar um produto final de cetona mais estável.
KET em Hidroboração de Alkynes
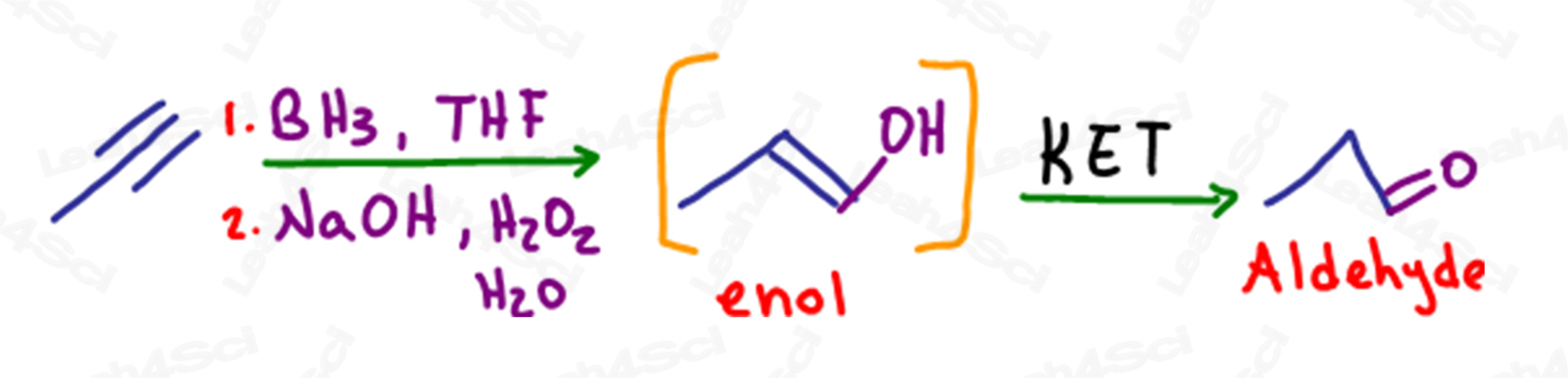
Como com alcenos, a hidroboração é uma reacção anti-Markovnikov na qual uma ligação pi é quebrada e um álcool é adicionado ao carbono menos substituído.
No caso de um alquino terminal, quando uma única ligação pi é transformada em álcool, o carbono terminal ainda tem uma ligação pi ou alceno, tornando-o um enol.
Esta molécula também sofrerá tautomerização para formar um produto aldeído mais estável.
Apesar de formar um aldeído, esta reacção ainda é considerada tautomerização do Keto enol.
Para estas 2 reacções, a cetona ou aldeído resultante é determinada pela localização do enol.
Se o enol estiver sobre um carbono interno (não terminal), o produto resultante irá formar uma cetona.
Se o enol for terminal, então o carbonilo resultante será um aldeído.
Tautomerização pode ocorrer tanto em condições de catalisação ácida como em condições de base.
Com as reacções acima referidas, considerar quais as condições que têm de ser depois de sofrer hidratação tal como está escrito.
O vídeo abaixo acompanha o passo a passo
- Reacção e mecanismo de tautomerização catalisada com ácido
- Reacção e mecanismo de tautomerização catalisada com base
- Reacção inversa (keto a enol) para ambas as reacções
Acido-Mecanismo de Tautomerização Catalítica
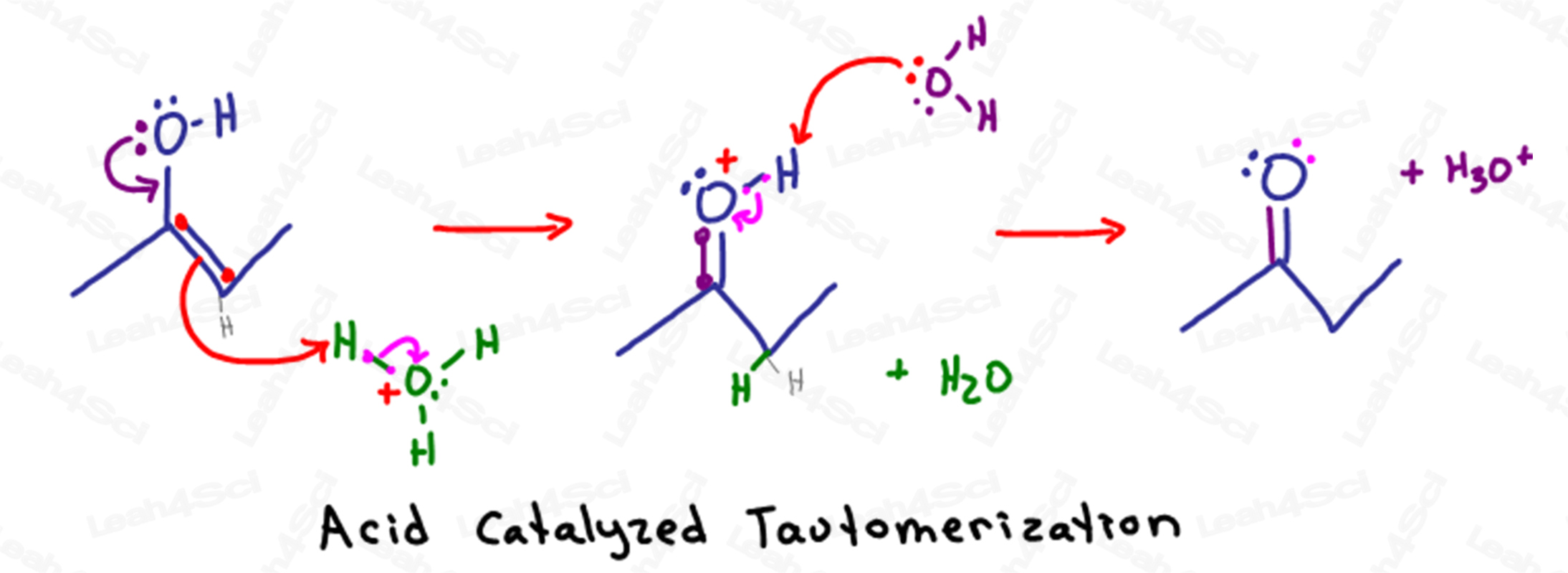
p>Lembrar que em soluções aquosas ácidas temos muita água e hidrónio (H3O+) disponível em solução.
Tautomerização começa quando os electrões parcialmente negativos no álcool oxigénio descem para atacar o átomo de carbono sp2 (aquele que mantém a ligação pi).
Na formação de uma segunda ligação entre carbono e oxigénio, o carbono teria um total de 5 ligações.
Para evitar violar o seu octeto, o carbono expulsará a ligação pi entre si e o outro átomo de carbono sp2 empurrando os electrões para o outro carbono.
Em vez de se sentar como um par solitário sobre o carbono, os electrões negativos são atraídos para o átomo H+ parcialmente positivo numa molécula de hidrónio próxima.
Desde que o átomo H+ só pode ter uma ligação, solta os electrões que o prendem ao oxigénio, permitindo que a água flutue em solução.
A molécula resultante parece uma cetona excepto para o átomo instável de oxigénio.
O oxigénio, com 2 ligações ao carbono, 1 ligação ao hidrogénio, e um único par solitário, tem uma carga positiva instável.
Uma outra molécula de água em solução utiliza os seus electrões parcialmente negativos para desprotonificar o oxigénio, devolvendo assim os seus electrões para formar uma cetona neutra e estável.
Vamos fazer alguma contabilidade rápida.
Esta reacção começou quando o enol atacou o hidrónio, o nosso catalisador ácido.
Na etapa final, a água desprotona a cetona, reformando o nosso catalisador ácido hidrónico.
Reminder: se o enol for terminal, o produto resultante é um aldeído em vez de uma cetona
Base-Mecanismo de Tautomerização Catalizada
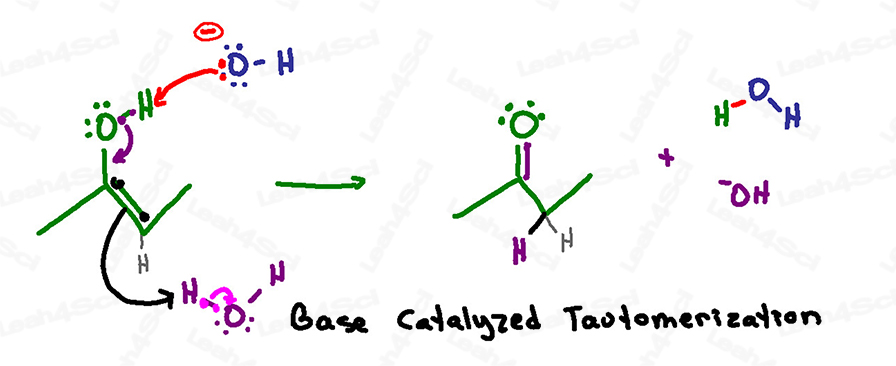
Reminder: numa solução aquosa básica, temos tanto hidróxido como água a flutuar.
Nunca mostrar H+ ou hidrónio numa solução básica!
Esta reacção é muito semelhante ao mecanismo catalisado pelo ácido, excepto que a desprotonação é o primeiro passo e não o último.
Isto porque a solução básica pode lidar com um oxigénio negativo, mas a solução ácida não permite a formação de um oxigénio negativo.
Esta reacção começa quando um hidróxido básico em solução alcança o hidrogénio ácido no enol.
Em vez de colapsar de volta ao oxigénio para formar um óxido negativo, os electrões rapidamente colapsam para baixo para formar uma ligação carbonil pi entre o carbono e o oxigénio.
Como com o mecanismo catalisado pelo ácido, o carbono deve expulsar a sua ligação dupla actual para evitar ter 5 ligações e violar o seu octeto.
Os electrões de ligação pi não se sentam e esperam no outro carbono, em vez disso, procuram e agarram um próton da solução – agarrando-o de uma molécula de água.
Numa única série de ataques (um passo), temos uma cetona como nosso produto final.
P>Toma atenção ao que foi utilizado e reformado nesta reacção:
Hidróxido agarrou um próton formando água,
Mas o enol agarrou um próton formando hidróxido de água e reformando assim o catalisador básico que iniciou esta reacção.
Reminder: se o enol for terminal, o produto resultante é um aldeído em vez de uma cetona