As ligações de hidrogénio podem formar-se entre o par solitário no próprio átomo de azoto electronegativo e o átomo de hidrogénio ligeiramente positivo noutra molécula.
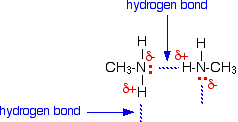
A ligação de hidrogénio não é tão eficiente como, digamos, na água, porque há falta de pares solitários. Alguns átomos de hidrogénio ligeiramente positivos não serão capazes de encontrar um par solitário para a ligação de hidrogénio. Há duas vezes mais hidrogénios adequados do que pares solitários.
Os pontos de ebulição das aminas primárias aumentam à medida que se aumenta o comprimento da cadeia devido à maior quantidade de forças de dispersão van der Waals entre as moléculas maiores.
Aminas secundárias
Para uma comparação justa teria de comparar o ponto de ebulição da dimetilamina com o da etilamina. São isómeros uns dos outros – cada um contém exactamente o mesmo número dos mesmos átomos.
O ponto de ebulição da amina secundária é um pouco inferior à amina primária correspondente com o mesmo número de átomos de carbono.
As aminas secundárias ainda formam ligações de hidrogénio, mas ter o átomo de azoto no meio da cadeia em vez de no fim torna o dipolo permanente na molécula ligeiramente inferior.
O ponto de ebulição inferior deve-se à menor atracção dipolo-dipolo na dimetilamina em comparação com a etilamina.
Aminas terciárias
Desta vez, para fazer uma comparação justa, teria de comparar a trimetilamina com o seu isómero 1-aminopropano.
Se olhar para a tabela mais acima, verá que a trimetilamina tem um ponto de ebulição muito mais baixo (3,5°C) que a 1-aminopropano (48,6°C).
Numa amina terciária não há átomos de hidrogénio ligados directamente ao azoto. Isto significa que a ligação de hidrogénio entre moléculas de aminas terciárias é impossível. É por isso que o ponto de ebulição é muito mais baixo.
Solubilidade em água
As pequenas aminas de todos os tipos são muito solúveis em água. De facto, as que seriam normalmente encontradas como gases à temperatura ambiente são normalmente vendidas como soluções em água – da mesma forma que o amoníaco é normalmente fornecido como solução de amoníaco.
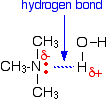
Todas as aminas podem formar ligações de hidrogénio com água – mesmo as terciárias.
Embora as aminas terciárias não tenham um átomo de hidrogénio ligado ao azoto e por isso não possam formar ligações de hidrogénio consigo mesmas, podem formar ligações de hidrogénio com moléculas de água utilizando apenas o par único no azoto.
Solubilidade cai à medida que as cadeias de hidrocarboneto se tornam mais longas – notavelmente após cerca de 6 carbonos. As cadeias de hidrocarbonetos têm de forçar o seu caminho entre moléculas de água, quebrando as ligações de hidrogénio entre moléculas de água.
No entanto, não as substituem por nada tão forte, e assim o processo de formação de uma solução torna-se cada vez menos viável energeticamente à medida que o comprimento da cadeia cresce.
Smell
As aminas muito pequenas como a metilamina e a etilamina têm um cheiro muito semelhante ao do amoníaco – embora se as compararmos lado a lado, os cheiros a amina são ligeiramente mais complexos.
As aminas crescem, tendem a cheirar mais a “peixe”, ou cheiram a apodrecimento.
Se estiver familiarizado com o cheiro da flor de espinheiro (e com o cheiro semelhante à flor de Cotoneaster), este é o cheiro da trimetilamina – um cheiro doce e um tanto adocicado como as fases iniciais da apodrecimento da carne.
p>Questões para testar a sua compreensão
Se esta é a primeira série de perguntas que fez, por favor leia a página introdutória antes de começar. Terá de usar o BOTÃO DE VOLTA no seu navegador para voltar aqui depois.
perguntas sobre a introdução às aminas
respostas
br>>
Onde gostaria de ir agora?
para o menu de aminas . . .
Para o menu de outros compostos orgânicos . . .
Para o menu principal . . . .