Lernziele
- Erläutern Sie die Funktion und den Farbwechsel von Säure-Base-Indikatoren
- Demonstrieren Sie, wie man den richtigen Indikator für ein Titrationsexperiment auswählt
- Bestimmen Sie die sauren Dissoziationskonstanten Ka oder Kai von Indikatoren.
Bestimmte organische Substanzen ändern in verdünnter Lösung ihre Farbe, wenn die Hydroniumionenkonzentration einen bestimmten Wert erreicht. Zum Beispiel ist Phenolphthalein eine farblose Substanz in jeder wässrigen Lösung mit einer Hydroniumionenkonzentration größer als 5,0 × 10-9 M (pH < 8,3). In basischeren Lösungen, in denen die Hydroniumionenkonzentration weniger als 5,0 × 10-9 M (pH > 8,3) beträgt, ist sie rot oder rosa. Substanzen wie Phenolphthalein, die zur Bestimmung des pH-Wertes einer Lösung verwendet werden können, werden als Säure-Base-Indikatoren bezeichnet. Säure-Base-Indikatoren sind entweder schwache organische Säuren oder schwache organische Basen.
Das Gleichgewicht in einer Lösung des Säure-Base-Indikators Methylorange, einer schwachen Säure, kann durch eine Gleichung dargestellt werden, in der wir HIn als einfache Darstellung für das komplexe Methylorange-Molekül verwenden:
\}{}=4.0×10^{-4}\]
Das Anion von Methylorange, In-, ist gelb, und die nichtionisierte Form, HIn, ist rot. Wenn wir einer Lösung von Methylorange Säure hinzufügen, verschiebt die erhöhte Hydroniumionenkonzentration das Gleichgewicht in Richtung der nichtionisierten roten Form, gemäß dem Prinzip von Le Chatelier. Wenn wir eine Base hinzufügen, verschiebt sich das Gleichgewicht in Richtung der gelben Form. Dieses Verhalten ist völlig analog zur Wirkung von Puffern.
Die Farbe eines Indikators ist das sichtbare Ergebnis des Verhältnisses der Konzentrationen der beiden Spezies In- und HIn. Wenn der größte Teil des Indikators (typischerweise 60-90 % oder mehr) als In- vorliegt, dann sehen wir die Farbe des In- Ions, die bei Methylorange gelb wäre. Liegt der größte Teil als HIn vor, dann sehen wir die Farbe des HIn-Moleküls: rot für Methylorange. Für Methylorange können wir die Gleichung für Ka umstellen und schreiben:
{}{}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}}]
Dies zeigt uns, wie das Verhältnis von \(\ce{\dfrac{}{}}\) mit der Konzentration des Hydroniumions variiert. Der obige Ausdruck, der das Indikator-Gleichgewicht beschreibt, kann umgeordnet werden:
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:pH=p\mathit{K}_a+log\left(\dfrac{}{}\right)}\]
Die letzte Formel entspricht der Henderson-Hasselbalch-Gleichung, mit der das Gleichgewicht von Indikatoren beschrieben werden kann.
Wenn sie den gleichen Zahlenwert wie Ka hat, ist das Verhältnis von to gleich 1, was bedeutet, dass 50 % des Indikators in der roten Form (HIn) und 50 % in der gelben Ionenform (In-) vorliegen und die Lösung orange gefärbt ist. Wenn die Hydroniumionenkonzentration auf 8 × 10-4 M steigt (ein pH-Wert von 3,1), färbt sich die Lösung rot. Bei einem weiteren Anstieg der Hydroniumionenkonzentration (Absinken des pH-Wertes) ist keine Farbänderung mehr sichtbar. Bei einer Hydroniumionenkonzentration von 4 × 10-5 M (einem pH-Wert von 4,4) liegt der größte Teil des Indikators in der gelben Ionenform vor, und eine weitere Abnahme der Hydroniumionenkonzentration (Erhöhung des pH-Werts) führt zu keiner sichtbaren Farbänderung. Der pH-Bereich zwischen 3,1 (rot) und 4,4 (gelb) ist das Farbwechselintervall von Methylorange; zwischen diesen pH-Werten findet der ausgeprägte Farbumschlag statt.
Als Indikatoren können viele verschiedene Substanzen verwendet werden, je nachdem, welche Reaktion überwacht werden soll. Zum Beispiel enthält Rotkohlsaft eine Mischung aus farbigen Substanzen, die sich von tiefrot bei niedrigem pH-Wert über hellblau bei mittlerem pH-Wert bis hin zu gelb bei hohem pH-Wert verändern (Abbildung \(\PageIndex{1}\)). In jedem Fall muss ein guter Indikator jedoch die folgenden Eigenschaften haben:
- Der Farbwechsel muss leicht zu erkennen sein.
- Der Farbwechsel muss schnell erfolgen.
- Das Indikatormolekül darf nicht mit der zu titrierenden Substanz reagieren.
- Um Fehler zu minimieren, sollte der Indikator einen pKin haben, der innerhalb einer pH-Einheit des erwarteten pH-Wertes am Äquivalenzpunkt der Titration liegt.

Rotkohlsaft enthält ein Gemisch von Substanzen, deren Farbe vom pH-Wert abhängt. Jedes Reagenzglas enthält eine Lösung von Rotkohlsaft in Wasser, aber der pH-Wert der Lösungen variiert von pH = 2,0 (ganz links) bis pH = 11,0 (ganz rechts). Bei pH = 7,0 ist die Lösung blau.
Es wurden synthetische Indikatoren entwickelt, die diese Kriterien erfüllen und praktisch den gesamten pH-Bereich abdecken. Abbildung \(\PageIndex{2}\) zeigt den ungefähren pH-Bereich, in dem einige gängige Indikatoren ihre Farbe ändern, sowie deren Farbwechsel. Darüber hinaus sind einige Indikatoren (wie Thymolblau) polyprotische Säuren oder Basen, die bei weit voneinander entfernten pH-Werten zweimal die Farbe wechseln.
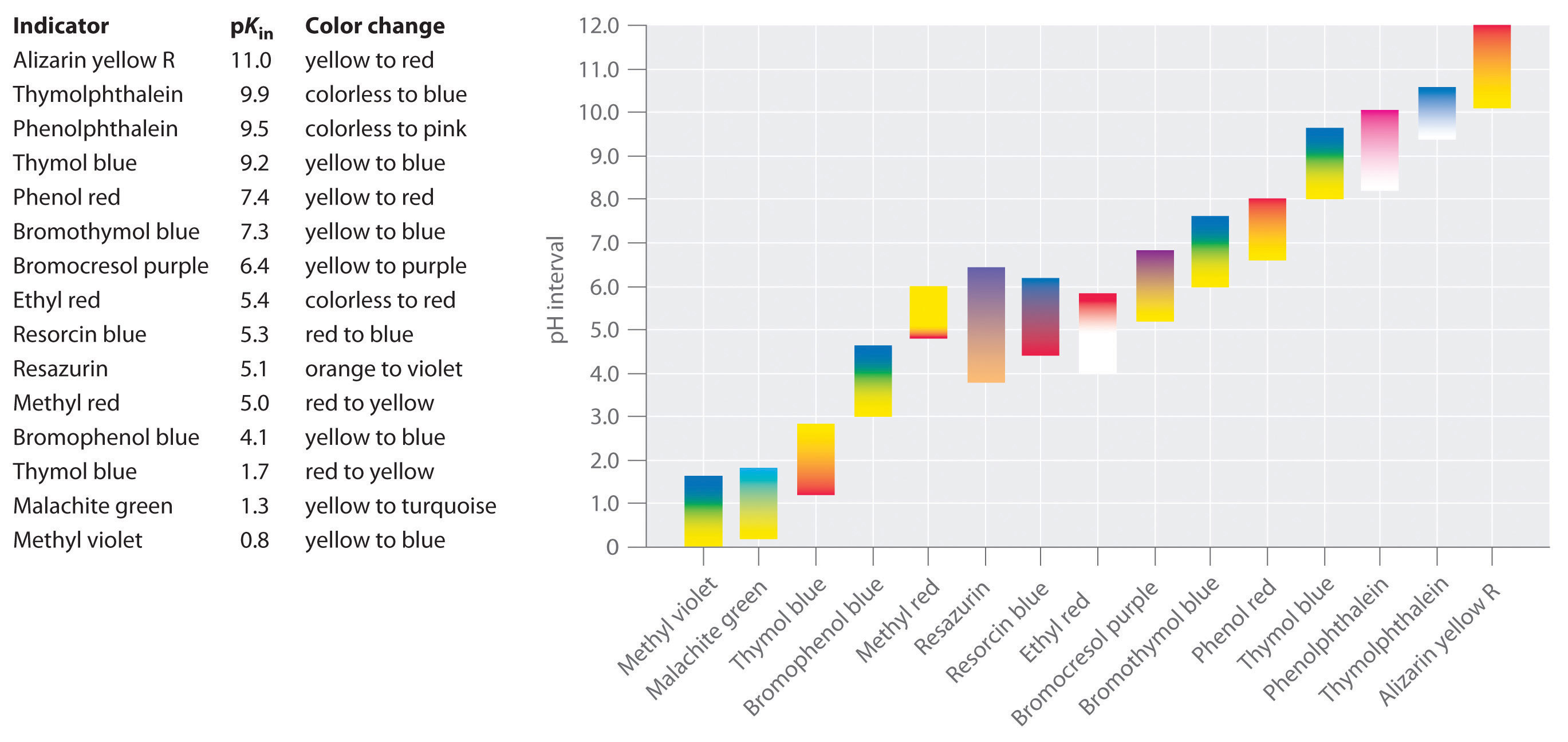
Es ist wichtig zu wissen, dass ein Indikator seine Farbe nicht abrupt bei einem bestimmten pH-Wert ändert; stattdessen macht er eine pH-Titration durch, genau wie jede andere Säure oder Base. Wenn die Konzentration von HIn sinkt und die Konzentration von In- steigt, ändert sich die Farbe der Lösung langsam von der charakteristischen Farbe von HIn zu der von In-. Wie wir in Abschnitt 16 sehen werden, ändert sich das /-Verhältnis von 0,1 bei einem pH-Wert eine Einheit unter pKin bis 10 bei einem pH-Wert eine Einheit über pKin. Somit ändern die meisten Indikatoren ihre Farbe über einen pH-Bereich von etwa zwei pH-Einheiten.
Wir haben festgestellt, dass ein guter Indikator einen pKin-Wert haben sollte, der nahe dem erwarteten pH-Wert am Äquivalenzpunkt liegt. Für eine starke Säure-Starke-Base-Titration ist die Wahl des Indikators nicht besonders kritisch, da um den Äquivalenzpunkt herum eine sehr große pH-Änderung auftritt. Im Gegensatz dazu kann die Verwendung des falschen Indikators für eine Titration einer schwachen Säure oder einer schwachen Base zu relativ großen Fehlern führen, wie in Abbildung \(\PageIndex{3}\) dargestellt. Diese Abbildung zeigt Diagramme des pH-Werts in Abhängigkeit vom Volumen der zugegebenen Base für die Titration von 50,0 mL einer 0,100 M Lösung einer starken Säure (HCl) und einer schwachen Säure (Essigsäure) mit 0,100 M \(NaOH\). Die pH-Bereiche, in denen zwei gängige Indikatoren (Methylrot, \(pK_{in} = 5,0\), und Phenolphthalein, \(pK_{in} = 9,5\)) ihre Farbe ändern, sind ebenfalls dargestellt. Die waagerechten Balken zeigen die pH-Bereiche an, in denen beide Indikatoren die Farbe ändern, und kreuzen die HCl-Titrationskurve, wo sie fast senkrecht verläuft. Beide Indikatoren ändern also ihre Farbe, wenn im Wesentlichen das gleiche Volumen an \(NaOH\) zugegeben wurde (etwa 50 mL), was dem Äquivalenzpunkt entspricht. Im Gegensatz dazu wird die Titration von Essigsäure sehr unterschiedliche Ergebnisse liefern, je nachdem, ob Methylrot oder Phenolphthalein als Indikator verwendet wird. Obwohl der pH-Bereich, in dem Phenolphthalein die Farbe ändert, etwas größer ist als der pH-Wert am Äquivalenzpunkt der Titration der starken Säure, ist der Fehler aufgrund der Steigung dieses Teils der Titrationskurve vernachlässigbar. Genau wie bei der HCl-Titration färbt sich der Phenolphthalein-Indikator rosa, wenn etwa 50 mL \(NaOH\) zu der Essigsäurelösung hinzugefügt wurden. Im Gegensatz dazu beginnt Methylrot bei pH 5 von rot nach gelb zu wechseln, was in der Nähe des Mittelpunkts der Essigsäuretitration liegt, nicht des Äquivalenzpunkts. Die Zugabe von nur etwa 25-30 mL NaOH führt daher zu einem Farbwechsel des Methylrot-Indikators und damit zu einem großen Fehler.
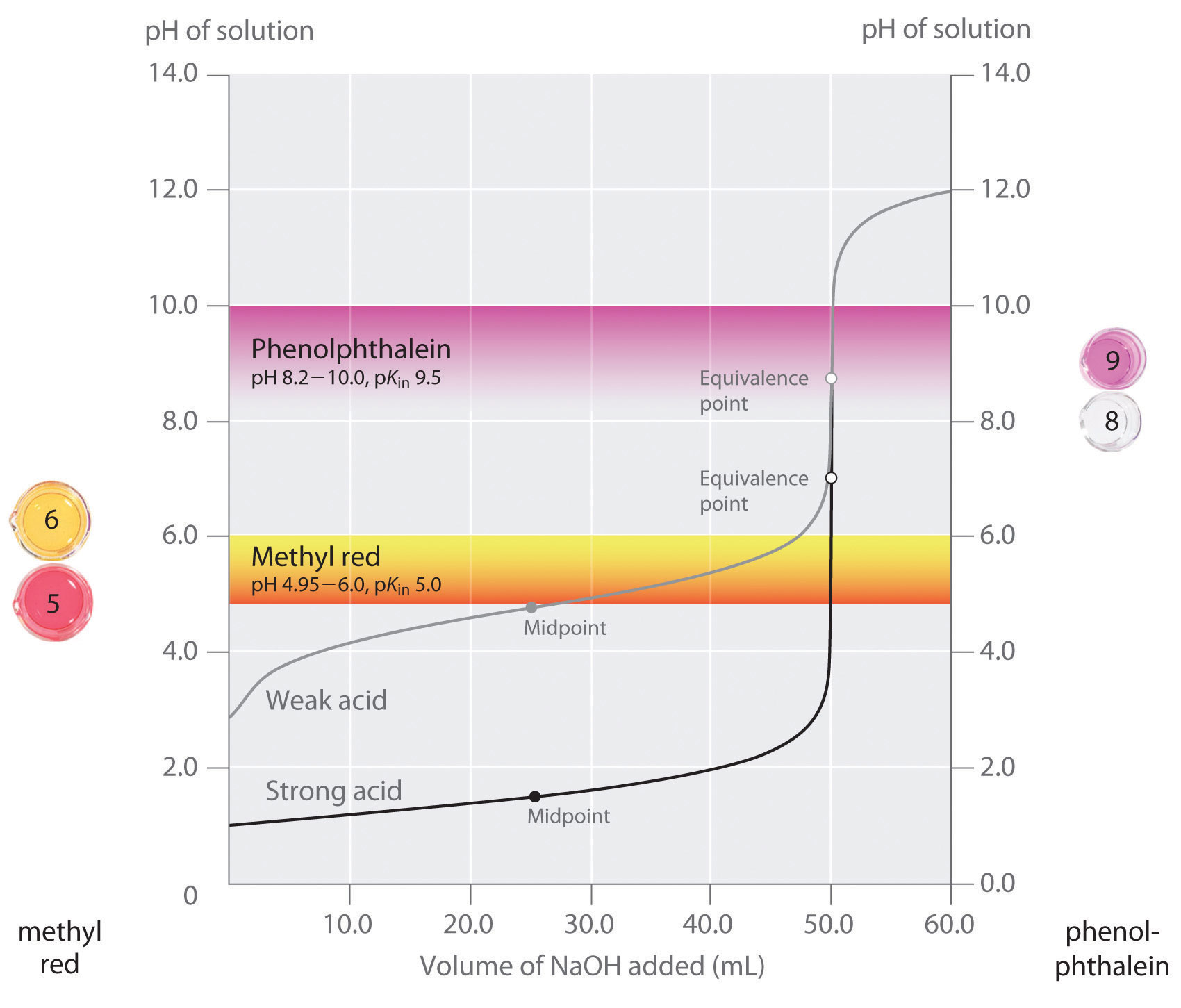
Die Grafik zeigt die Ergebnisse, die mit zwei Indikatoren (Methylrot und Phenolphthalein) für die Titration von 0,100 M Lösungen einer starken Säure (HCl) und einer schwachen Säure (Essigsäure) mit 0,100 M \(NaOH\) erzielt wurden. Aufgrund der Steilheit der Titrationskurve einer starken Säure um den Äquivalenzpunkt herum werden beide Indikatoren bei der Titration der starken Säure am Äquivalenzpunkt schnell die Farbe wechseln. Im Gegensatz dazu liegt der pKin von Methylrot (5,0) sehr nahe am pKa von Essigsäure (4,76); der Mittelpunkt des Farbumschlags bei Methylrot liegt in der Nähe des Mittelpunkts der Titration und nicht am Äquivalenzpunkt.
Im Allgemeinen ist für Titrationen von starken Säuren mit starken Basen (und umgekehrt) jeder Indikator mit einem pKa zwischen etwa 4,0 und 10,0 geeignet. Für die Titration einer schwachen Säure ist der pH-Wert am Äquivalenzpunkt jedoch größer als 7,0, so dass ein Indikator wie Phenolphthalein oder Thymolblau mit einem pKin > 7,0 verwendet werden sollte. Umgekehrt sollte für die Titration einer schwachen Base, bei der der pH-Wert am Äquivalenzpunkt kleiner als 7,0 ist, ein Indikator wie Methylrot oder Bromkresolblau mit einem pKin < 7.0, verwendet werden.
Beispiel \(\PageIndex{1}\)
Bei der Titration einer schwachen Säure mit einer starken Base, welcher Indikator wäre die beste Wahl?
- Methyl Orange
- Bromkresolgrün
- Phenolphtalein
Lösung
Die richtige Antwort ist C. Bei der Titration einer schwachen Säure mit einer starken Base wird die konjugierte Base der schwachen Säure den pH-Wert am Äquivalenzpunkt größer als 7 machen. Daher würden Sie wollen, dass sich ein Indikator in diesem pH-Bereich verändert. Sowohl Methylorange als auch Bromkresolgrün ändern ihre Farbe in einem sauren pH-Bereich, während Phenolphtalein in einem basischen pH-Bereich wechselt.
Das Vorhandensein vieler verschiedener Indikatoren mit unterschiedlichen Farben und pKin-Werten bietet auch eine bequeme Möglichkeit, den pH-Wert einer Lösung zu schätzen, ohne ein teures elektronisches pH-Meter und eine zerbrechliche pH-Elektrode zu verwenden. Papier- oder Kunststoffstreifen, die mit Kombinationen von Indikatoren imprägniert sind, werden als „pH-Papier“ verwendet, mit dem Sie den pH-Wert einer Lösung schätzen können, indem Sie einfach ein Stück pH-Papier in die Lösung tauchen und die resultierende Farbe mit den auf dem Behälter aufgedruckten Standards vergleichen (Abbildung \(\PageIndex{4}\)).
Zusammenfassung
Säure-Base-Indikatoren sind Verbindungen, die bei einem bestimmten pH-Wert die Farbe ändern. Sie sind typischerweise schwache Säuren oder Basen, deren Farbänderungen der Deprotonierung oder Protonierung des Indikators selbst entsprechen.
Autoren und Zuschreibungen
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) und Richard Langley (Stephen F. Austin State University) sind mitwirkende Autoren. Die Lehrbuchinhalte wurden von OpenStax College produziert und stehen unter einer Creative Commons Attribution License 4.0 Lizenz. Kostenloser Download unter http://cnx.org/contents/85abf193-2bd…[email protected]).
- {template.ContribBoundless()}}