Wie in den vorangegangenen Abschnitten angedeutet, erlaubt das polare Wassermolekül den Wassermolekülen, untereinander Bindungen einzugehen. Diese Bindungen werden als Wasserstoffbrückenbindungen bezeichnet. Betrachten wir Natriumchlorid (Salz), eine Verbindung mit Ionenbindungen, so konnten wir nachweisen, dass allein durch das Einbringen von Kochsalz in Wasser die elektrostatische Anziehung zwischen den Natrium- und Chlorid-Ionen um das 80-fache reduziert werden kann. Da immer mehr Natrium- und Chlorid-Ionen durch die Schwächung der elektrostatischen Anziehung, die sie zusammenhält, frei werden, werden sie von den polaren Molekülen des Wassers umgeben – was als „Hydratation“ bezeichnet wird.“

Wasser löst mehr Substanzen als jede andere gewöhnliche Flüssigkeit, indem es „Salze“ in einzelne „Ionen“ zerlegt (z.B. NaCl in Na+ und Cl-) und diese Ionen hydratisiert, damit sie nicht miteinander wechselwirken. So haben polare Wassermoleküle eine Anziehungskraft für Ionen (Atome oder Gruppen von Atomen mit einer Ladung), wobei „Kationen“ Ionen mit positiver Ladung und „Anionen“ mit negativer Ladung sind. Die meisten Elemente haben hohe Löslichkeiten in Wasser, was bedeutet, dass sich große Konzentrationen dieser Elemente aufbauen können, bevor die Fähigkeit der Wassermoleküle, die Ionen zu isolieren, überschritten wird. Der Punkt, an dem z. B. Na und Cl beginnen würden, ein Salz im Meerwasser auszufällen, wird als „Sättigung“ bezeichnet. Für NaCl (das Mineral „Halit“) tritt dies bei heutigem Meerwasser erst dann ein, wenn es zur Verdunstung kommt und das Volumen des Meerwassers auf etwa 10 % seines ursprünglichen Volumens reduziert ist.
Meerwasser ist im Wesentlichen eine NaCl-Lösung, die im Durchschnitt eine Konzentration von 35 g NaCl/kg Wasser (oder 3,5 % Salz) aufweist. Na und Cl machen über 85 % der gesamten gelösten Feststoffe (Salz) aus, aber es sind noch andere wichtige Ionen vorhanden. Die relative Häufigkeit der Ionen im Meerwasser lautet in der Reihenfolge: Cl, Na, SO4, Mg, Ca, K. Zusammen machen diese Ionen >99% der gelösten Feststoffe im Meerwasser aus. Mit nur vier anderen Elementen – HCO3 (Bicarbonat), Br, Sr, B, F – haben wir 99,99% aller gelösten Feststoffe. Ladungen müssen sich ausgleichen, so dass die positive Ladung, die mit Na+, Mg+2, Ca+2, K+ verbunden ist, gleich der negativen Ladung ist, die mit Cl-, SO4-2 (und HCO3-) verbunden ist. Wir glauben nicht, dass Sie es anders haben wollen. Stellen Sie sich vor, wie die Strömung vom Meer zu Ihnen, der Sie am Strand sitzen, aussehen würde, wenn die Ladungen nicht ausgeglichen wären – schockierend!
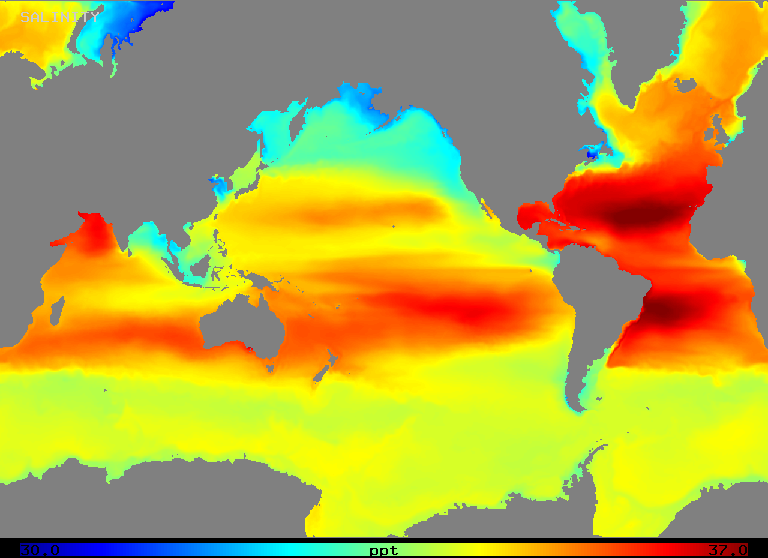
Der Salzgehalt variiert im offenen Ozean über einen Bereich von etwa 32 bis 37 o/oo, wie Abbildung 2 (unten) zeigt. Beachten Sie, dass Gebiete mit dem höchsten Salzgehalt in Regionen mit der höchsten Nettoverdunstung auftreten, wie man es erwarten könnte.
Alle anderen gelösten Substanzen im Meerwasser haben sehr niedrige Konzentrationen (Teile pro Million oder Milliarde) (ppm oder ppb; 10-6 bis 10-9). Dazu gehören wichtige Nährstoffe wie Phosphat und Nitrat, die von Organismen im Kreislauf geführt werden (Elemente, die als „biolimitierend“ bezeichnet werden) und für das Leben unerlässlich sind. Viele Metalle haben Spurenkonzentrationen (wollen Sie reich werden? Im Meerwasser sind etwa 9 Millionen Tonnen Gold gelöst, was in etwa dem gesamten Gold entspricht, das im Laufe der Geschichte auf der Erde abgebaut wurde).
Wie bereits angedeutet, führt die Verdunstung von Meerwasser zu einer vorhersehbaren Abfolge von Mineralsalzen (Mineralien werden an einem bestimmten Punkt gesättigt). Nach Verdunstung von wenigen % der Wassermasse fällt CaCO3 (Calcit) aus; nach Verdunstung von 81 % fällt CaSO4 (Gips) vollständig aus; nach Verdunstung von etwa 90,5 % fällt NaCl (Halit) vollständig aus; bei 96 % Verdunstung fallen die K- und Mg-Salze (mit SO4 und Cl) aus. Es ist genug Salz im Ozean vorhanden, um das Land mit einer 170 m dicken Schicht zu bedecken. Natürliche Ablagerungen aus alten Ozeanen wie diese nennt man „Evaporite“
.