Pravin U. Dugel, MD
Phoenix
El edema macular cistoide pseudofáquico fue descrito por primera vez por A. Ray Irvine Jr, MD,1 en 1953 y fue dilucidado por J. Donald M Gass, MD, en 1969.2 El Dr. Gass describió que el pico de incidencia se producía a las seis semanas del postoperatorio, y sugirió que había una diferencia entre el EMCP angiográfico y el clínicamente significativo, ya que sólo unos pocos pacientes se quejaban de disminución de la visión. El EMCP clínico se define ahora como una agudeza visual Snellen de 20/40 o peor. Los síntomas más comunes son la disminución de la agudeza visual y de la sensibilidad al contraste, así como la metamorfopsia.
Aunque la adopción de la facoemulsificación en lugar de la extracción extracapsular de cataratas ha disminuido la tasa de EMCP del 16 al 24 por ciento,3 el uso cada vez mayor de implantes de lentes intraoculares multifocales ha generado mayores expectativas en los pacientes. Debido al diseño de estos nuevos implantes, que disminuyen intrínsecamente la sensibilidad al contraste, incluso la EMCP leve puede dar lugar a una reducción significativa de la calidad de la visión y la satisfacción del paciente. Cuando la Administración de Alimentos y Medicamentos (FDA) aprueba el uso de cualquier LIO nueva, establece que la «tasa aceptable» de EMCP clínicamente significativa debe ser inferior al 5 por ciento. Dada la rápida evolución de la tecnología quirúrgica y de las LIOs, puede ser necesario redefinir la PCME «clínicamente significativa» para que se ajuste tanto a los requisitos visuales como a las expectativas del paciente.
Incidencia
La incidencia de PCME tras la facoemulsificación en pacientes sin complicaciones y de bajo riesgo puede variar entre el 2 y el 12 por ciento.4,5 Se cree que el pico de incidencia se produce seis semanas después de la cirugía.2 Los factores que predicen el desarrollo de EMCP en esta población incluyen los antecedentes de oclusión de la vena retiniana, la presencia de una membrana epirretiniana y el uso preoperatorio de prostaglandinas.4 En pacientes con características de alto riesgo, como la diabetes mellitus, o en casos complicados, la incidencia puede ser mucho mayor. (Heier JS, et al. Characteristics of patients with CME following phacoemulsification. Presentado en la Reunión Anual de la Academia Americana de Oftalmología; noviembre de 2007; Nueva Orleans, LA.)
Mecanismo
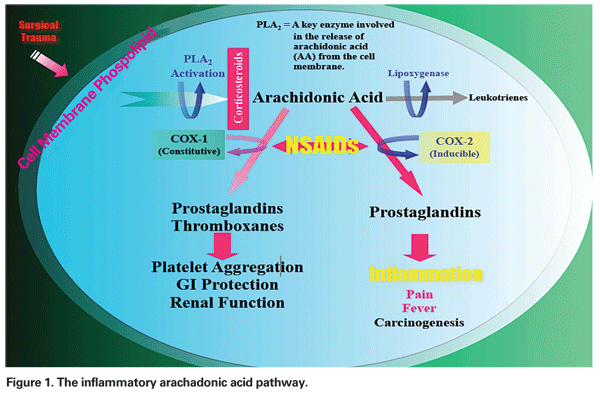
El mecanismo por el que se desarrolla el EMC puede ser multifactorial, teniendo diversos grados de componentes inflamatorios y mecánicos. La manipulación quirúrgica del segmento anterior desencadena la liberación de ácido araquadónico de las membranas celulares, lo que conduce a la producción de prostaglandinas y leucotrienos a través de las vías de la ciclooxigenasa (COX) y la lipoxigenasa (LOX), respectivamente (véase la figura 1). Estos mediadores inflamatorios aumentan la vasopermeabilidad, lo que conduce al desarrollo de la EMCP.
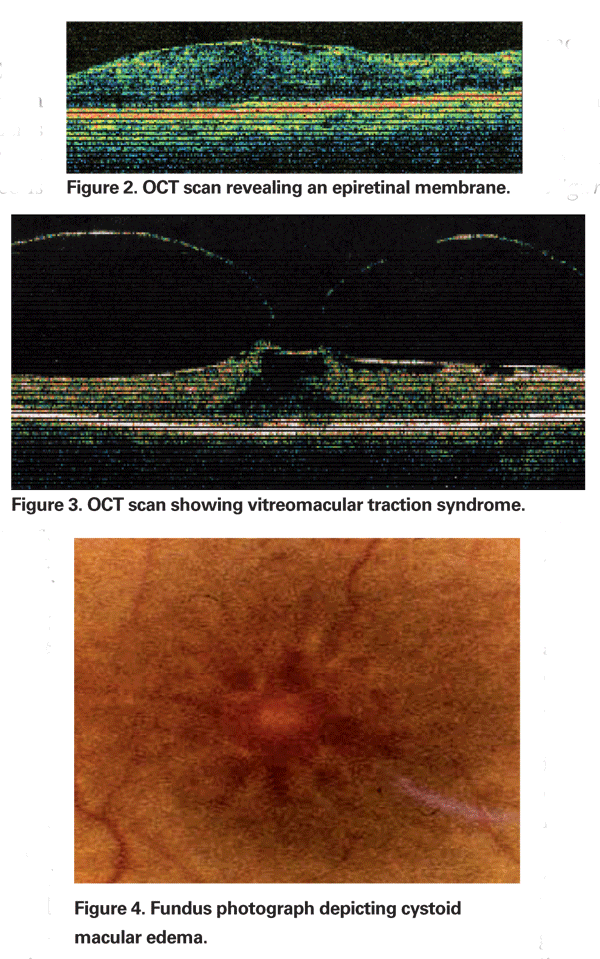
En ocasiones, la inflamación producida por la extracción de cataratas puede causar la contracción de la cara hialoidea posterior, lo que conduce a la distorsión de los capilares parafoveales y el edema macular resultante. El uso creciente de la tomografía de coherencia óptica se ha convertido en una parte importante de la evaluación del EMCP. Las imágenes de la OCT son útiles para identificar un componente mecánico del EMC, incluyendo la tracción vitreomacular o las membranas epirretinianas (Ver Figuras 2 & 3).
En casos raros de EMCP crónica y refractaria en pacientes de bajo riesgo sin ninguna otra etiología identificable, el ojo debe ser examinado de cerca para detectar fragmentos de cristalino retenidos, malposición de la LIO o la presencia de infección por Propionibacterium acnes.
Diagnóstico
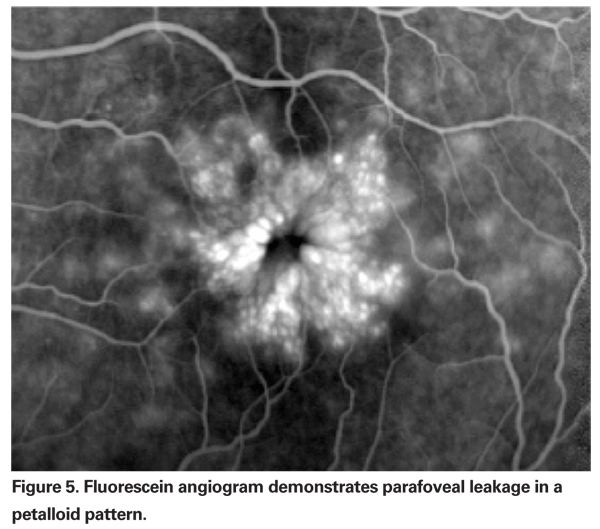
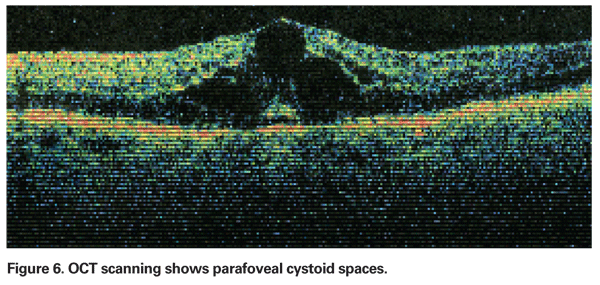
La EMPC debe sospecharse cuando un paciente sin factores de riesgo subyacentes se queja de disminución de la visión o metamorfopsia tras la extracción de cataratas. Clínicamente, se puede observar un edema intrarretiniano contenido en espacios tipo quiste en un patrón de panal alrededor de la fóvea (Ver Figura 4). En la angiografía con fluoresceína, se puede observar un patrón petaloide de fuga en los espacios intrarretinianos parafoveales, junto con una hiperfluorescencia del disco óptico (véase la figura 5). La OCT puede demostrar claramente estos espacios cistoides, así como calcular el grosor macular central y el volumen macular total (véase la figura 6). Las ventajas de la OCT son su alta sensibilidad, su carácter no invasivo, la entrega de información anatómica y la capacidad de cuantificar el edema macular, aunque existe una dudosa correlación de estos valores y la función visual.
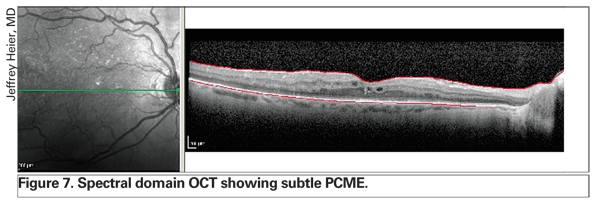
El uso de la OCT está revolucionando el manejo del edema de retina. La tecnología más reciente, incluida la OCT de dominio espectral, ofrece una mejor resolución y puede detectar el edema de retina sutil antes que la biomicroscopía con lámpara de hendidura y la angiografía con fluoresceína (véase la figura 7). Además, esta instrumentación mejorada permite al clínico distinguir entre el edema intrarretiniano exclusivamente y el líquido epitelial subretiniano o subpigmentario, lo que puede proporcionar información pronóstica (véase la figura 8). Según la experiencia de varios especialistas en retina, la presencia de un desprendimiento epitelial pigmentario subfoveal puede presagiar un peor pronóstico.
Prevención
Hay varias revisiones retrospectivas y ensayos prospectivos que evalúan el efecto de los antiinflamatorios noantiinflamatorios no esteroideos profilácticos sobre las tasas de EMCP cuando se utilizan en el preoperatorio frente al postoperatorio. En un informe, tres días de tratamiento previo con ketorolac trometamina (Acular) fue superior a las gotas administradas una hora antes de la cirugía.6 Cuando se comparó con el tratamiento con corticosteroides postoperatorios solos, otro grupo informó de una reducción de la EMCP del 12 por ciento al 0 por ciento con dos días de diclofenaco sódico (Voltaren) preoperatorio y la combinación de diclofenaco/corticosteroides postoperatoria.5
Utilizando la OCT para cuantificar el volumen macular, los investigadores descubrieron que dos días de tratamiento previo con ketorolaco y la terapia combinada postoperatoria con ketorolaco/esteroides condujeron a una reducción del 46 por ciento de la inflamación macular un mes después de la cirugía en comparación con un grupo de control que sólo tomaba esteroides.7 Recientemente, un ensayo prospectivo aleatorizado que comparaba tres días de ketorolac preoperatorio y terapia combinada con corticosteroides solos informó de que, según la OCT, los pacientes del grupo de control tenían una incidencia del 2,4 por ciento de EMCP en comparación con el 0 por ciento en la cohorte de la combinación.8 Aunque los pacientes del grupo de corticosteroides tuvieron una incidencia significativamente mayor de engrosamiento de la retina ≥15 µm, no hubo diferencias estadísticas en la agudeza visual mejor corregida entre los dos grupos cuatro semanas después de la cirugía.
En una evaluación prospectiva de tres grupos asignados a indometacina tópica durante tres días antes de la operación seguida de terapia combinada, terapia combinada postoperatoria solamente, o corticosteroide solamente, la incidencia de EMCP angiográfica se redujo del 32.La incidencia de EMCP angiográfica se redujo del 32,8% (sólo corticosteroides) al 15% (combinación postoperatoria) y al 0% (AINE pre y postoperatorio).9
En otro informe se indica que la adición de nepafenaco sódico (Nevanac) a un régimen postoperatorio de corticosteroides redujo las tasas de EMCP del 2,1% al 0% en comparación con el corticosteroide solo.10 Una reciente comparación prospectiva aleatoria de diclofenaco solo frente a betametasona en el postoperatorio descubrió que, a las cinco semanas de la cirugía, la incidencia de ECM angiográfica era menor en el grupo de los AINE (18,8%) que en el grupo de los corticosteroides (58,0%).11
Estos estudios demuestran que el uso profiláctico de AINEs reduce la incidencia de EMC, y que su eficacia es mayor cuando se inicia al menos tres días antes de la operación y se continúa en el postoperatorio durante varias semanas. Sin embargo, el momento exacto y la duración del tratamiento preoperatorio y postoperatorio, así como la identificación de los pacientes que más se beneficiarían, siguen sin determinarse.
Características de alto riesgo
Como se ha mencionado anteriormente, en una serie de 1,659 casos consecutivos, la membrana epirretiniana, los antecedentes de oclusión venosa o el uso preoperatorio de análogos de las prostaglandinas aumentaron en gran medida el riesgo de desarrollo de EMCP.4 Al examinar una serie de pacientes consecutivos remitidos a una clínica de retina para el tratamiento del EMCP, otro grupo encontró que las características de alto riesgo eran la diabetes mellitus, la hipertensión, la cirugía ocular previa, la membrana epirretiniana y la extracción complicada de cataratas. (Heier JS, et al.) Dado que una variedad de malestares médicos y oculares pueden predisponer a los pacientes al desarrollo de PCME, la identificación de estos pacientes y la terapia profiláctica agresiva con AINEs tópicos debe ser utilizada para reducir el riesgo de desarrollar PCME.
Tratamientos
– AINE. Esta clase de medicamentos inhibe la producción de prostaglandinas a través de la inhibición de la vía de la COX (véase la figura 1). Como los AINE no tienen ningún efecto sobre los niveles de prostaglandinas preformados o existentes, el tratamiento antes del traumatismo quirúrgico es esencial. En un reciente artículo de revisión, el autor recomendó el tratamiento preoperatorio con AINE durante dos días en los pacientes de bajo riesgo y una semana en los de alto riesgo, con la continuación durante al menos cuatro semanas en el postoperatorio en ambos grupos.12
Aún existen dudas sobre qué AINE es más eficaz para prevenir o tratar la EMPC.
Los AINE de nueva generación, como el bromfenaco sódico (Xibrom) y el nepafenaco, tienen modificaciones en su estructura química, lo que aumenta su penetración ocular y su potencia teórica.13 En ensayos in vitro se ha descubierto que la potencia relativa de la inhibición de la COX-2 es 18 veces mayor para el bromfenaco que para el ketorolaco, aunque se desconoce la importancia clínica de estos datos.14 Un estudio de farmacocinética in vivo reveló que las concentraciones en el humor acuoso del nepafenaco comercializado (nepafenaco más amfenaco) son significativamente mayores que las del bromfenaco o el ketorolaco.15 Sin embargo, se desconoce si estas diferencias de penetración se traducen en mejores resultados clínicos. Aunque se han hecho numerosas afirmaciones de marketing que implican que la mejor penetración, los cambios estructurales y la mayor potencia propuesta de los AINE de nueva generación se traducen en una mayor eficacia clínica, no se ha realizado ningún estudio definitivo que lo confirme.
– Terapia combinada. Un ensayo prospectivo, aleatorizado y con doble enmascaramiento, que evaluó el ketorolac frente a la prednisolona frente a la terapia combinada para la EMCP clínicamente significativa, descubrió que los pacientes que recibieron la terapia combinada alcanzaron un cambio medio de ≥2 líneas de visión en su segunda visita, mientras que los pacientes de los dos grupos de monoterapia nunca alcanzaron una mejora media de dos líneas a los tres meses de seguimiento16. Los pacientes tratados con la terapia combinada o con ketorolac solo también respondieron más rápidamente que los pacientes del grupo de prednisolona.
– Inyecciones de corticosteroides. Los corticosteroides actúan más arriba en la misma vía que los AINE, inhibiendo la liberación de ácido araquadónico de los fosfolípidos de la membrana celular, impidiendo así la formación tanto de leucotrienos como de prostaglandinas (Ver Figura 1).
Se sigue debatiendo sobre la vía de administración más eficaz (subtenoniana o intravítrea), la dosis óptima (4 mg o más) y la seguridad del paciente (riesgos de hipertensión ocular, desprendimiento de retina, hemorragia vítrea y endoftalmitis).
Actualmente, no existen ensayos clínicos aleatorios que evalúen estos modos de tratamiento, y los resultados publicados parecen contradictorios.
Un grupo de investigadores descubrió que la triamcinolona intravítrea para el EMCP persistente dio lugar a una mejora de la agudeza visual, una disminución del grosor macular y un aumento de los valores del electrorretinograma multifocal.17 Otro informó de que el uso de 4 mg de AITV en la EMCP crónica refractaria dio lugar a una mejora anatómica y funcional después de un mes de la inyección y que persistió durante al menos tres meses.18 Sin embargo, el efecto beneficioso fue temporal, ya que la agudeza visual y el grosor macular volvieron a los niveles previos a la inyección a pesar de los múltiples tratamientos. En otra serie pequeña, los pacientes mantuvieron una mejora de la agudeza y una disminución del grosor macular tras una única dosis de 4 mg de IVTA para la EMCP refractaria.19
– Acetazolamida. La acetazolamida aumenta el transporte de líquido subretiniano y se ha demostrado que elimina el edema cistoide foveal en trastornos como la retinosis pigmentaria, la afaquia y la formación de membranas epirretinianas maculares.20-23 Hay un puñado de informes de casos que correlacionan la resolución del EMCP con el uso de acetazolamida oral, pero hasta la fecha no se han realizado ensayos clínicos.
– Agentes del factor de crecimiento endotelial vascular. El traumatismo quirúrgico provoca una inflamación postoperatoria que puede dar lugar a un EMCP a través de un aumento de la producción de factores vasopermeables como el factor de crecimiento endotelial vascular. Una vez más, pequeñas series de casos proporcionan pruebas contradictorias. Después de la inyección intravítrea con bevacizumab (Avastin), un grupo descubrió que el 71% de los pacientes ganaron dos o más líneas de visión ETDRS;24 y otro informó de que todos los ojos de su serie tuvieron una mejora estadísticamente significativa de la visión.25 Sin embargo, otro estudio informó de que el bevacizumab intravítrea no mejoró la agudeza visual en pacientes con EMCP.26
– Vitrectomía. La vitrectomía de la pars plana con exfoliación de la membrana puede considerarse en los casos de EMCP con un componente mecánico identificado en el examen clínico o mediante OCT, o en los casos de edema crónico refractario que no responde al tratamiento médico. En una pequeña serie, la intervención quirúrgica dio lugar a una mejora de más de tres líneas en la agudeza visual mejor corregida en la mayoría de los pacientes, y a la resolución del EMCP en todos los casos.27 También hay informes de casos en la literatura que indican una mejora visual tras la vitrectomía y el pelado de la membrana limitante interna.28 Como se ha mencionado anteriormente, la vitrectomía pars plana debe considerarse en los casos de fragmentos de cristalino retenidos, malposición de la LIO o infección por P. acnes.
Direcciones futuras
Como se ha mencionado anteriormente, los corticosteroides actúan al principio de la cascada inflamatoria. Posurdex (Allergan) es un sistema biodegradable de administración sostenida de dexametasona que se implanta en la cavidad vítrea. Su matriz polimérica se transforma gradualmente en ácido láctico y glicólico, que a su vez se descomponen en agua y dióxido de carbono. En un estudio de fase II, el 54 por ciento de los pacientes que padecían EMC y EMC asociada a uveítis mostraron una mejora de al menos 10 letras de agudeza en el día 90 tras el implante, frente a sólo el 14 por ciento que mostró un resultado similar en el grupo de observación.
Recientemente, la FDA aprobó Triesence (Alcon), acetónido de triamcinolona, para la inyección intravítrea durante la cirugía. Este fármaco puede utilizarse fuera de etiqueta en el algoritmo de tratamiento de la EMCP recalcitrante.
Es evidente que la definición de EMCP ha ido evolucionando en los últimos años. Con aproximadamente 3 millones de cirugías de cataratas realizadas en los Estados Unidos al año y con las expectativas aumentadas de los pacientes, es importante que los especialistas en retina entiendan la variada patogénesis, los factores de riesgo y el manejo adecuado de la PCME. Las nuevas tecnologías han revolucionado y revolucionarán el diagnóstico, el pronóstico y el tratamiento de esta enfermedad.
Los autores ejercen en Retinal Consultants of Arizona, Phoenix. El Dr. Jamal también ejerce en Texas Retina Associates, Dallas, y el Dr. Goldenberg ejerce en Associated Retinal Consultants, Royal Oak, Mich. Contacte con el Dr. Dugel en pdugel @gmail.com.
1. Irvine SR. Un síndrome vítreo recientemente definido después de la cirugía de cataratas. Am J Ophthalmol 1953; 36:599-619.
2. Gass JD, Norton EW. Estudio de seguimiento del edema macular cistoide tras la extracción de cataratas. Trans Am Acad Ophthalmol Otolaryngol 1969;73(4):665-82.
3. Wright PL, Wilkinson CP, Balyeat HD, et al. Angiographic cystoid macular edema after posterior chamber lens implantation. Arch Ophthalmol 1988;106:740-744.
4. Henderson BA, Kim JY, Ament CS, et al. Clinical pseudophakic cystoid macular edema. Factores de riesgo para el desarrollo y la duración después del tratamiento. J Cataract Refract Surg 2007;33:1550-8.
5. McColgin AZ, Raizman MB. Eficacia de Voltaren tópico en la reducción de la incidencia de edema macular cistoide postoperatorio. Invest Ophthmol Vis Sci 1999;40 S289.
6. Donnenfeld ED, Perry HD, Wittpenn JR, et al. Preoperative ketorolac tromethamine 0.4 percent in phacoemulsification outcomes: Curva de respuesta farmacocinética. J Cataract Refract Surg 2006;32:1474-82.
7. Almeida DR, Johnson D, Hollands H, Smallman D, et al. Efecto de los fármacos antiinflamatorios no esteroideos profilácticos en el edema macular cistoide evaluado mediante cuantificación por tomografía de coherencia óptica del volumen macular total después de la cirugía de cataratas. J Cataract Refract Surg 2008;34:64-9.
8. Wittpenn JR, Silverstein S, Heier J, et al. A Randomized, Masked Comparison of Topical Ketorolac 0.4 percent Plus Steroid vs Steroid Alone in Low-Risk Cataract Surgery Patients. Am J Ophthalmol 2008; 146:554 -560.
9. Yavas GF, Oztürk F, Küsbeci T. Preoperative topical indomethacin to prevent pseudophakic cystoid macular edema. J Cataract Refract Surg 2007;33:804-7.
10. Wolf EJ, Braunstein A, Shih C, et al. Incidencia de edema macular pseudofáquico visualmente significativo tras una facoemulsificación sin incidentes en pacientes tratados con nepafenaco. J Cataract Refract Surg 2007;33:1546-1549.
11. Asano S, Miyake K, Ota I, et al. Reducción del edema macular cistoide angiográfico y de la alteración de la barrera hemato-acuosa tras la facoemulsificación con incisión pequeña y la implantación de lentes intraoculares plegables: Comparación aleatoria prospectiva multicéntrica de diclofenaco tópico al 0,1 por ciento y betametasona al 0,1 por ciento. J Cataract Refract Surg 2008;34:57-63.
12. O’Brien TP. Directrices emergentes para el uso de la terapia con AINE para optimizar el cuidado del paciente de cirugía de cataratas. Curr Med Res & Opin. 2005;21:1131-1137.
13. Walsh DA, Moran HW, Shamblee DA, et al. Antiinflammatory agents 3. Síntesis y evaluación farmacológica del ácido 2-amino-3-benzoilfenilacético y análogos. J Medicinal Chem 1984;27:1379-1388.
14. Waterbury LD, Silliman D, Jolas T. Comparación de la actividad inhibidora de la ciclooxigenasa y los efectos antiinflamatorios oculares de ketorolac trometamina y bromfenaco sódico. Curr Med Res Opin 2006;22: 1133-1140.
15. Walters TR, Raizman M, Ernest P, et al. Farmacocinética in vivo y farmacodinámica in vitro de nepafenaco, amfenaco, ketorolaco y bromfenaco. J Cataract Refract Surg 2007;33;1539-1545.
16. Heier JS, Topping TM, Baumann W, et al. Ketorolac versus prednisolona versus terapia combinada en el tratamiento del edema macular cistoide agudo pseudofáquico. Ophthalmology 2000;107:2034-8.
17. Koutsandrea C, Moschos MM, Brouzas D, et al. Acetónido de triamcinolona intraocular para el edema macular cistoide pseudofáquico: Estudio de tomografía de coherencia óptica y electrorretinografía multifocal. Retina 2007;27:159-64.
18. Boscia F, Furino C, Dammacco R, et al. Acetónido de triamcinolona intravítrea en el edema macular cistoide refractario pseudofáquico: Resultados funcionales y anatómicos. Eur J Ophthalmol 2005;15:89-95.
19. Karacorlu M, Ozdemir H, Karacorlu S. Intravitreal triamcinolone acetonide for the treatment of chronic pseudophakic cystoid macular oedema. Acta Ophthalmol Scand 2003;81:648-52.
20. Marmor MF. Hipótesis sobre el tratamiento con anhidrasa carbónica del EMC: Ejemplo con la membrana epirretiniana. Arch Ophthalmol 1990;108:1524-1525.
21. Cox SN, Hay E, Bird AC. Tratamiento del edema macular crónico con acetazolamida. Arch Ophthalmol 1988;106:1190-1195.
22. Fishman GA, Gilbert COT, Fiscella RG et al. Acetazolamide for treatment of chronic macular edema in retinitis pigmentosa. Arch Ophthalmol 1989;107:1445-1452.
23. Wolfensberger TJ, Chiang R, Takeuchi A et al. Inhibition of membrane-bound carbonic anhydrase enhances subretinal fluid absorption and retinal adhesiveness. Graefe’s Arch Clin Exp Ophthalmol 2000; 238:76-80.
24. Arévalo JF, García-Amaris RA, Roca JA, et al. Bevacizumab intravítreo primario para el manejo del edema macular cistoide pseudofáquico: Estudio piloto del Grupo Colaborador Panamericano de Estudio de la Retina. J Cataract Refract Surg. 2007;33:2098-105.
25. Barone A, Russo V, Prascina F, et al. Seguridad y eficacia a corto plazo de Bevacizumab Intravítreo para el Edema Macular Cistoide Pseudofáquico. Retina 2008 Oct 9.
26. Spitzer MS, Ziemssen F, Yoeruek E, et al. Eficacia de bevacizumab intravítreo en el tratamiento del edema macular cistoide postoperatorio. J Cataract Refract Surg 2008;34:70-5.
27. Pendergast SD, Margherio RR, Williams GA, et al. Vitrectomy for chronic pseudophakic cystoid macular edema. Am J Ophthalmol 1999;128:317-23.
28. Peyman GA, Canakis C, Livir-Rallatos C, et al. The effect of internal limiting membrane peeling on chronic recalcitrant pseudophakic cystoid macular edema: A report of two cases. Am J Ophthalmol 2002;133:571-2.