INTRODUCCIÓN
Los virus del papiloma humano (VPH) conforman un grupo viral heterogéneo; su genoma está constituido por una molécula de ADN de doble cadena helicoidal con una cápside proteica. Están formados por entidades epiteliotrópicas que infectan el estado basal del epitelio y, en consecuencia, conservan su transcripción y replicación del ADN a niveles basales, produciendo lesiones hiperplásicas papilomatosas y verrugosas en la piel y las mucosas.1
Existen más de 230 tipos de VPH (118 de ellos bien caracterizados) y más de 40 tipos anal-genitales, de los cuales 15 son oncogénicos. En humanos, representan uno de los grupos virales que más frecuentemente infectan el epitelio de la piel y las mucosas conjuntivas, la cavidad oral (genotipos 33 y 32) la laringe, el árbol bronquial, el esófago, la vejiga, el ano y el tracto genital.2,3
En el caso del VPH lingual, existen dos grandes grupos de presentación clínica:
a) lesiones benignas y b) lesiones premalignas o malignas. Entre las lesiones orales benignas podemos encontrar el papiloma oral, la verruga oral vulgar (verruga común), el condiloma oral acumina y la hiperplasia epitelial focal (enfermedad de Hecks).4-6 Las lesiones malignas y premalignas están representadas principalmente por la leucoplasia y el carcinoma de células escamosas.7
El papiloma escamoso de la mucosa oral es la lesión papilar más frecuentemente encontrada, representa el 2,5% o todas las lesiones encontradas en la boca.6 Las lesiones clínicas del VPH se observan con mayor frecuencia en el labio superior, el labio inferior, el frenillo lingual, el dorso de la lengua y las comisuras de los labios.8
La morfología más comúnmente observada de estas lesiones asume una forma similar a la de una coliflor, sin embargo, pueden observarse otras formas como verrugas comunes, hiperqueratosis o incluso superficies no queratinizadas, que presentan cambios de color superficiales (normalmente un tono violáceo).9 Según las referencias bibliográficas, esta enfermedad se transmite mayoritariamente a través de una práctica sexual buco-genital.10
El objetivo del presente estudio fue realizar una revisión bibliográfica sobre la revisión de la papilomatosis oral, así como reportar un caso clínico.
HISTOLOGÍA DE LA LENGUA
Las células localizadas en la lengua exhiben una disposición estructural poliestructurada. Se asientan sobre un estrato córneo (superficial), una capa granular, una capa espinosa y una capa basal (capa más profunda). El núcleo de estas células cambia de tamaño según su madurez y especialización.11
GENOMA DEL VIRUS DEL PAPILOMA
Las partículas virales están compuestas por una cápside proteica que está compuesta por un 95% de proteína L1 y un 5% de proteína L2. Estas proteínas se unen para formar capsómeros icosaédricos. Dentro de la cápside se encuentra un ADN circular de doble cadena de aproximadamente 8000 pares de bases. Está formado por ocho genes y una región reguladora no codificada; esta región contiene sitios de enlace para los factores hormonales y proteicos del huésped, necesarios para que el virus complete su ciclo de replicación.12
El virus del VPH está conformado de manera similar por dos tipos de genes: genes codificados durante las primeras etapas de la infección, más conocidos como genes E (E de temprano) y genes codificados durante las últimas etapas de la replicación conocidos: E1, E2, E4, E5, E6, E7 (aunque el E4 se considera un gen tardío), así como dos genes tardíos, L1 y L2. Los genes tempranos codifican proteínas implicadas en la replicación y regulación viral, así como en su capacidad carcinogénica. Por otro lado, los genes tardíos codifican proteínas estructurales que forman una cápside viral.12,13
El ciclo de vida del VPH
El VPH entra en el huésped a través de una pequeña abrasión en el epitelio integral de la lengua.13 A continuación, inicia su ciclo productivo infectando células poco diferenciadas de las capas basales del epitelio, donde comienza la transcripción de los genes.12
Cuando las células infectadas se diferencian y migran de la capa basal a la capa espinosa del epitelio (permisividad inmunológica), se estimula la replicación viral produciendo así la acumulación del virión dentro del núcleo y el ensamblaje de la cápside en el citoplasma. Existen al menos dos ciclos de replicación viral: a) infección lítica y b) infección lisogénica.
En los casos de infección lítica, el virus llega a las células para-basales con capacidad de replicación, penetra en el citoplasma y posteriormente en el núcleo. Una vez dentro del núcleo, se replica en la zona episomal, sin integrarse en el genoma celular, produciendo así aproximadamente 20 copias virales. Estas partículas virales completas provocan la muerte de la célula y permanecen así libres y en la proximidad de las superficies epiteliales.
En los casos de infección lisogénica el genoma celular se ve directamente afectado. Este es el caso de los VPH de alto riesgo (16 y 18). Tras alcanzar el núcleo celular, el virus se integra en el genoma celular del huésped, principalmente en los segmentos E6 y E7. En este caso, la replicación del virus asume una fase de latencia hasta que la célula huésped replica su propio ADN y el de los virus integrados. Los segmentos de ADN viral son transcripcionalmente activos después de la división celular; esto garantiza su propagación13 A diferencia de los casos de infección lítica, este tipo de infección se observa en las células que experimentan un crecimiento maligno.
La expresión génica de los diferentes tipos de VPH está regulada de forma estricta y específica a través de factores de transcripción como el AP-1, el factor específico de los queratinocitos, el NF-1CTF, el CEFI, el CEFII y el TEFI, así como algunos factores de origen hormonal.
En ambos tipos de infección, las proteínas E1 y E2 inician su expresión en sentido ascendente (suprarregulación), activando así la transcripción del ADN así como la expresión controlada de las células basales.12
Los genes E6 y E7 del VPH están directamente relacionados con la transformación maligna de las células a través de las oncoproteínas E6 y E7. Estas proteínas son capaces de formar compuestos con productos génicos celulares que regulan el ciclo celular, entre los que se encuentran p53 y Rb. La oncoproteína E6 crea un compuesto con la proteína p53, mientras que la E7 crea un compuesto con la proteína Rb.
La proteína Rb regula el paso de G1 a S La oncoproteína E7 secuestra a Rb impidiendo que regule las proteínas de proliferación celular, esto obliga a que el ciclo celular permanezca en fase de síntesis.13 Estos dos eventos: la integración del gen viral al genoma celular y el bloqueo de la función normal de los genes supresores de tumores p53 y Rb están asociados a la transformación celular de las células infectadas con virus de alto potencial oncogénico (16 y 18). Los cambios progresivos que experimentan los queratocitos modifican el microambiente y alteran el equilibrio del epitelio a través de estímulos de proliferación celular guiados por la secreción de factores de crecimiento epidérmico alfa y beta.
Las proteínas E2, E3, E4, E5, E6 y E7 inducen la pérdida de control de las proteínas génicas (ADN episomal en el centro del núcleo) mientras que E6 y E7 replican el ADN viral. L1 y L2 ensamblan el virus y se colocan en las células escamosas maduras para posteriormente desprenderse (más de 1.000 copias por célula).
En las lesiones benignas, como el papiloma de lengua, la proliferación de las partículas de ADN episomal promueve el crecimiento anormal del epitelio, aumentando así los errores génicos de las células (gastogénesis).
E6 y E7 promueven la proliferación e inmortalización del virus. Cuando el virus posee potencial oncogénico provoca la malignización, cuando no, se desarrolla una lesión benigna que puede autolimitarse en un periodo de dos años. Este mecanismo es inducido principalmente por la pérdida de los telómeros del ADN, que inhibe la apoptosis, aumenta el número de células infectadas y disminuye la acetilación y fosforilación de p53 y Rb. Además, se promueve la expresión de factores angiogénicos. Tal es el caso del factor de crecimiento vascular que desorganiza el citoesqueleto celular y la matriz extracelular afectando a los factores de regulación que intervienen en la salud de estas estructuras.12
La infección por el VPH provoca importantes cambios en la morfología celular. Por ejemplo, se observa la formación de vacuolas perinucleares, núcleos agrandados, irregulares e hipercromáticos, así como la bionucleación. Las células que han sufrido estos cambios se denominan koylocitos y se consideran la «huella digital» del virus.
El condiloma es la manifestación morfológica más común de la infección por VPH (condiloma acuminado).14
PRESENTACIÓN DEL CASO
La paciente era una mujer soltera de 21 años. No trabajaba fuera de casa, había nacido y residía en el Estado de México. Su grupo sanguíneo era O, Rh positivo. Como parte de sus antecedentes familiares informó que su padre era portador de esclerosis múltiple y que una hermana padecía artritis reumatoide. La paciente negó tener adicción a las drogas. Tenía múltiples fibroadenomas mamarios juveniles en la mama izquierda, que fueron tratados quirúrgicamente. Inició la menarquia a los 15 años, con un ritmo menstrual de 28 × 3. La actividad sexual comenzó a los 17 años. Refirió una pareja sexualmente activa, negó la práctica de sexo oral-genital. Experimentó un embarazo y dio a luz a un niño de 3,1 kg de peso vivo.
Un año antes había sido sometida a estudios de citología y colposcopia en el tracto genital inferior, además de revisión mamaria. Los resultados fueron negativos para cáncer y VPH. El método de planificación familiar utilizado por la paciente era el dispositivo intrauterino.
La paciente acudió a consulta por primera vez en abril de 2014, quejándose de glosodinia ventral de tres meses de evolución. Tras ello, experimentó sensación de cuerpo extraño y abultamiento en los tejidos blandos, con crecimiento centrífugo progresivo hasta la formación de un tumor en forma de lenteja que sangraba al contacto con el paladar duro y durante la masticación. Acudió a consulta médica donde recibió tratamiento sistémico no especificado que no obtuvo resultados satisfactorios.
Se inspeccionó la boca mediante un procedimiento de colposcopia con aumento de 0,66x (colposcopio Hinselmann, 2014 México). Dicho procedimiento reveló una lesión de aproximadamente 1cm de diámetro, de tonalidad rosada, de forma circular, con bordes dentados, sin pedículo y de naturaleza avascular (Figura 1). Una vez finalizado el estudio, se informó a la paciente sobre el diagnóstico y el tratamiento deseable.
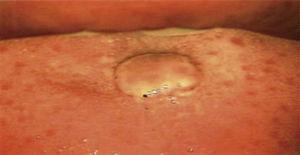
Inspección directa de la boca bajo perspectiva colposcópica. I (Hinselmann, 2014), con 0,66 aumentos. Lesión que mide 1cm de diámetro, de tono rosado, forma circular, bordes dentados, avascular y sin pedículo.
TRATAMIENTO
Bajo anestesia local y xilocaína al 2% con epinefrina (1mL) se infiltró la base de la lesión con una aguja de calibre 30G. Se recortó la superficie de la lesión y se diseccionó realizando una disección en cuña. Una vez conseguida la hemostasia, se encararon los bordes (Dermalon 000) en un plano con suturas invertidas. La muestra obtenida se fijó en 5 ml de formol al 10% para ser enviada al Departamento de Patología.
Quince días después se retiraron las suturas y se obtuvo así una zona quirúrgica sana (Figura 2). El informe histopatológico reveló la presencia de tejido con medidas de 0,6 × 0,5 cm. El espécimen era de forma irregular, de color marrón oscuro y de consistencia blanda. El análisis microscópico reveló un epitelio corneal poliestratificado, acantosis e hiperqueratosis. El interior de la muestra revelaba focos de cornificación intraepitelial de diferentes tamaños. En general, las células epiteliales eran de menor tamaño que las del estrato espinoso normal (Figuras 3 y 4). El diagnóstico final indicó un papiloma escamoso de la lengua. La tipificación genética viral realizada con reacción en cadena de la polimerasa (PCR) en tiempo real informó de la presencia de un genotipo 58 (virus de alto riesgo).
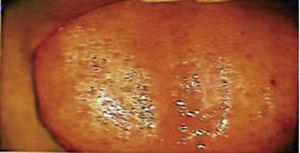
Fotografía de la lengua bajo perspectiva colposcópica 15 días después de la cirugía.
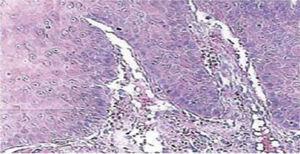
Ampliación microscópica 10x. Epitelio corneal poliestratificado, acantosis e hiperqueratosis.
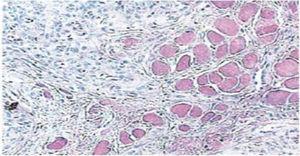
40 x Ampliación microscópica. Focos de cornificación intraepitelial de diferentes tamaños.
DISCUSIÓN
El VPH es un virus de ADN; pertenece a la familia de los papovavíridos, del género de los papilomavirus. Se han descrito más de 230 genotipos. El periodo de incubación varía de tres semanas a ocho meses, con una media de tres meses. De los 230 genotipos de papilomavirus, 16 se asocian con mayor frecuencia a las lesiones orales (1, 2, 3, 4, 6, 7, 10, 11, 13, 16, 31, 32, 33, 35 y 57).
Hay dos grupos principales de presentación clínica del VPH: a) lesiones benignas y b) lesiones premalignas o malignas. Las lesiones orales benignas incluyen el papiloma oral, la verruga vulgar, el condiloma acuminado oral y la hiperplasia epitelial focal (enfermedad de Heck). Las lesiones premalignas y malignas están representadas principalmente por la leucoplasia y el carcinoma de células escamosas asociados a los genotipos 16 y 18. La transmisión del VPH se realiza a través de prácticas sexuales orogenitales.
Existen varias técnicas para diagnosticar el VPH, entre ellas podemos contar la citología convencional, la citología de base líquida, la histología, la colposcopia y las técnicas de biología molecular como la hibridación in situ y la reacción en cadena de la polimerasa (PCR).15,16 En el caso clínico aquí presentado se decidió realizar la tipificación genética del virus con PCR, este procedimiento reveló la presencia de un genotipo 58. Este dato no ha sido documentado en la clasificación reportada en la literatura.
El tratamiento se adapta a cada caso individual. Se pueden utilizar técnicas destructivas, como la crioterapia o la electrocirugía, el uso de inmunemoduladores (imiquimod al 5%), o el uso de un antimetabolito para interferir con el ARN (ácido ribo-nucleico) y el ADN, o mediante la inhibición de la timidilato sintetasa (5-fluororacilo).17,18 En el presente caso se decidió utilizar la cirugía con bisturí frío en función del lugar de aparición de la lesión, para acogerse a la posibilidad de no dejar secuelas.
En la mucosa oral expuesta a microtraumatismos, tanto los microorganismos como los factores químicos y físicos pueden actuar sinérgicamente con el VPH para propiciar el desarrollo de lesiones benignas o de carcinoma.
El VPH juega un papel importante en el desarrollo del carcinoma de células escamosas en el tracto anal y genital, así como en la epidermodisplasia verruciforme, y en la laringe.
En las lesiones benignas, los genotipos 33 y 32 son los más frecuentes. Sin embargo, en nuestro estudio, el informe del procedimiento de biología molecular indicó la presencia del genotipo 58.
En la literatura mundial no se ha reportado la tipificación del gen 58 en este tipo de lesiones que clínicamente parecen exhibir un comportamiento benigno.
Para el abordaje exitoso de esta afección, es de suma importancia el diagnóstico y tratamiento interdisciplinario entre odontólogos, oncólogos y ginecólogos adecuadamente entrenados en el estudio de estas lesiones bajo la perspectiva colposcópica.
El tratamiento ejecutado a través de la intervención quirúrgica con bisturí frío, con el objetivo de dejar los bordes libres de lesiones es una solución adecuada para erradicar este tipo de lesiones y no causar secuelas, sobre todo en tumores que aparentemente son clínicamente benignos, pero que de acuerdo a su tipo genético, tendrán un comportamiento maligno a mediano y largo plazo.
Consideramos interesante el reporte del presente caso, ya que existen pocos reportes relacionados con esta condición en la bibliografía científica mexicana.