Como se ha indicado en apartados anteriores, la molécula de agua polar permite que las moléculas de agua formen enlaces entre sí. Estos enlaces se denominan enlaces de hidrógeno. Si consideramos el cloruro de sodio (sal), un compuesto que contiene enlaces iónicos, podríamos demostrar que simplemente colocando sal de mesa en agua, por ejemplo, podemos reducir la atracción electrostática entre los iones de sodio y cloruro en 80 veces. A medida que se liberan más y más iones de sodio y cloro por el debilitamiento de la atracción electrostática que los mantiene unidos, se rodean de las moléculas polares del agua, lo que se denomina «hidratación».»

El agua disuelve más sustancias que cualquier otro líquido común al dividir las «sales» en «iones» componentes (por ejemplo, NaCl en Na+ y Cl-) e hidratar esos iones para evitar que interactúen. Así, las moléculas polares de agua ejercen una atracción por los iones (átomos o grupos de átomos con carga), donde los «cationes» son iones con carga positiva y los «aniones» tienen carga negativa. La mayoría de los elementos tienen altas solubilidades en el agua, lo que significa que pueden acumularse grandes concentraciones de esos elementos antes de que se supere la capacidad de las moléculas de agua para aislar los iones. El punto en el que el Na y el Cl, por ejemplo, comenzarían a precipitar una sal en el agua de mar se denomina «saturación». En el caso del NaCl (el mineral «halita»), esto sólo ocurre a partir del agua de mar actual cuando se produce la evaporación y el volumen del agua de mar se reduce a aproximadamente el 10% de su volumen original.
El agua de mar es esencialmente una solución de NaCl que tiene una concentración media de 35 g de NaCl/kg de agua (o 3,5% de sal). El Na y el Cl componen más del 85% de los sólidos disueltos totales (sal), pero hay otros iones importantes presentes. La abundancia relativa de iones en el agua de mar se clasifica por orden: Cl, Na, SO4, Mg, Ca, K. Juntos, estos iones constituyen el >99% de los sólidos disueltos en el agua de mar. Con sólo otros cuatro elementos -HCO3 (bicarbonato), Br, Sr, B, F- tenemos el 99,99% de todos los sólidos disueltos. Las cargas deben equilibrarse, por lo que la carga positiva asociada al Na+, Mg+2, Ca+2, K+ es igual a la carga negativa asociada al Cl-, SO4-2 (y HCO3-). No creemos que lo quieras de otra manera. Piense en cuál sería el flujo de la corriente desde el mar hasta usted, sentado en la playa, si las cargas no estuvieran equilibradas… ¡Impresionante!
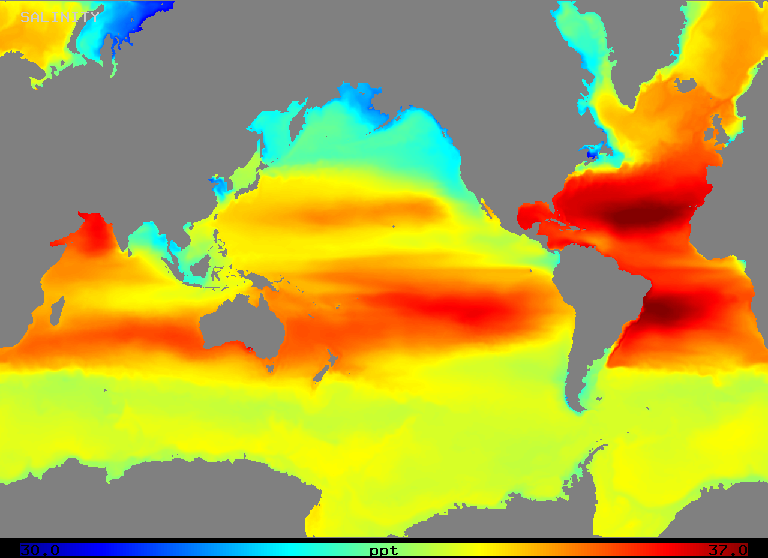
La salinidad varía en un rango de aproximadamente 32 a 37 o/oo en el océano abierto, como ilustra la Figura 2 (abajo). Obsérvese que las zonas de mayor salinidad se dan en las regiones de mayor evaporación neta, como cabría esperar.
Todas las demás sustancias disueltas en el agua de mar se encuentran en concentraciones muy bajas (parte por millón o billón) (ppm o ppb; 10-6 a 10-9). Esto incluye nutrientes importantes, como el fosfato y el nitrato, que son ciclados por los organismos (elementos llamados «biolimitantes») y son esenciales para la vida. Muchos metales tienen concentraciones de trazas (¿quieres hacerte rico? Hay unos 9 millones de toneladas de oro disueltas en el agua de mar, lo que equivale a todo el oro extraído en la tierra a lo largo de la historia).
Como se ha indicado anteriormente, la evaporación del agua de mar produce una secuencia predecible de sales minerales (los minerales se saturan en un momento determinado). Tras la evaporación de unos pocos % de la masa de agua, precipita el CaCO3 (calcita); tras la evaporación del 81%, precipita totalmente el CaSO4 (yeso); tras la evaporación de aproximadamente el 90,5%, precipita totalmente el NaCl (halita); al 96% de evaporación, caen las sales de K y Mg (con SO4 y Cl). Hay suficiente sal en el océano para cubrir la tierra con una capa de 170 m de espesor. Los depósitos naturales de antiguos océanos como éste se llaman «evaporitas».