- Definir la presión.
- Aprender las unidades de presión y cómo convertir entre ellas.
La teoría cinética de los gases indica que las partículas del gas están siempre en movimiento y chocan con otras partículas y con las paredes del recipiente que las contiene. Aunque las colisiones con las paredes del recipiente son elásticas (es decir, no hay una ganancia o pérdida neta de energía debido a la colisión), una partícula de gas ejerce una fuerza sobre la pared durante la colisión. La acumulación de todas estas fuerzas distribuidas en el área de las paredes del recipiente provoca algo que llamamos presión. La presión (P) se define como la fuerza de todas las colisiones partícula de gas/pared dividida por el área de la pared:
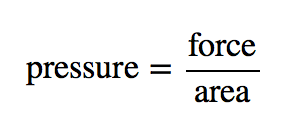
Todos los gases ejercen presión; es una de las magnitudes fundamentales medibles de esta fase de la materia. Incluso nuestra atmósfera ejerce presión; en este caso, el gas está siendo «retenido» por la gravedad terrestre, en lugar de estar el gas en un recipiente. La presión de la atmósfera es de 101.325 Pa.
La presión tiene varias unidades. La unidad formal de presión aprobada por el SI es el pascal (Pa), que se define como 1 N/m2 (un newton de fuerza sobre un área de un metro cuadrado). Sin embargo, su magnitud suele ser demasiado pequeña para ser útil. Una unidad común de presión es la atmósfera (atm), que se definió originalmente como la presión atmosférica media a nivel del mar.
Sin embargo, la «presión atmosférica media a nivel del mar» es difícil de precisar debido a las variaciones de la presión atmosférica. Una unidad más fiable y común son los milímetros de mercurio (mmHg), que es la cantidad de presión ejercida por una columna de mercurio de exactamente 1 mm de altura. Una unidad equivalente es el torr, que equivale a 1 mmHg (el torr recibe su nombre de Evangelista Torricelli, un científico italiano del siglo XVII que inventó el barómetro de mercurio). Con estas definiciones de presión, se redefine la unidad de atmósfera: 1 atm se define exactamente como 760 mmHg, o 760 torr. Así pues, tenemos las siguientes equivalencias:
1 atm = 760 mmHg = 760 torr
Podemos utilizar estas equivalencias, como cualquier otra, para realizar conversiones de una unidad a otra. Relacionándolas con la unidad formal de presión del SI, 1 atm = 101,325 Pa.
Ejemplo 1
¿Cuántas atmósferas hay en 595 torr?
Solución
Utilizando las equivalencias de presión, construimos un factor de conversión entre torr y atmósferas: 1 atm = 760 torr. Así,

Como los números del factor de conversión son exactos, el número de cifras significativas de la respuesta final viene determinado por el valor inicial de la presión.
Ponte a prueba
¿Cuántas atmósferas hay en 1,022 torr?
Respuesta
1,345 atm
Ejemplo 2
La atmósfera en Marte es mayoritariamente de CO2 a una presión de 6,01 mmHg. Cuál es esta presión en atmósferas?
Solución
Utiliza las equivalencias de presión para construir el factor de conversión adecuado entre milímetros de mercurio y atmósferas.
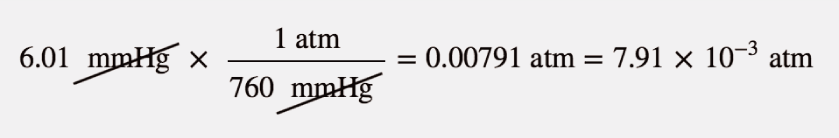
Al final, expresamos la respuesta en notación científica.
Ponte a prueba
La presión atmosférica es baja en el ojo de un huracán. En un huracán de 1979 en el Océano Pacífico, se registró una presión de 0,859 atm dentro del ojo. ¿Cuál es esta presión en torr?
Respuesta
652 torr
- La presión es una fuerza ejercida sobre un área.
- La presión tiene varias unidades comunes que se pueden convertir.
Ejercicios
-
Define la presión. ¿Qué la provoca?
-
Define y relaciona tres unidades de presión.
-
Si una fuerza de 16.7 N es presionada contra un área de 2,44 m2, ¿cuál es la presión en pascales?
-
Si una fuerza de 2.546 N es presionada contra un área de 0.0332 m2, ¿cuál es la presión en pascales?
-
Explique por qué la definición original de atmósfera no funcionaba bien.
-
¿Qué unidades de presión son iguales entre sí?
-
¿Cuántas atmósferas hay en 889 mmHg?
-
¿Cuántas atmósferas hay en 223 torr?
-
Cuántos torr hay en 2,443 atm?
-
¿Cuántos milímetros de mercurio hay en 0,334 atm?
-
¿Cuántos milímetros de mercurio hay en 334 torr?
-
¿Cuántos torr hay en 0,777 mmHg?
-
¿Cuántos pascales hay en 1 torr?
-
Una presión de 0,887 atm equivale a cuántos pascales?
Respuestas
La presión es la fuerza por unidad de superficie. Es causada por las partículas de gas que chocan contra las paredes de su contenedor.
6,84 Pa
Debido a que la presión atmosférica a nivel del mar es variable, no es una unidad de presión consistente.
1,17 atm
1,857 torr
334 mmHg
133 Pa