Objetivos de aprendizaje
- Aprender los términos básicos utilizados para describir la materia.
La definición de química -el estudio de las interacciones de la materia con otra materia y con la energía- utiliza algunos términos que también deben ser definidos. Comenzamos el estudio de la química definiendo algunos términos básicos.
Materia. Un libro es materia, un ordenador es materia, los alimentos son materia y la suciedad del suelo es materia. A veces la materia puede ser difícil de identificar. Por ejemplo, el aire es materia, pero como es tan fino comparado con otras materias (por ejemplo, un libro, un ordenador, la comida y la tierra), a veces olvidamos que el aire tiene masa y ocupa espacio. Entre las cosas que no son materia se encuentran los pensamientos, las ideas, las emociones y las esperanzas.
Ejemplo 1
¿Cuál de las siguientes cosas es materia y no es materia?
- un perrito caliente
- el amor
- un árbol
- Un perrito caliente tiene masa y ocupa espacio, por lo que es materia.
- El amor es una emoción, y las emociones no son materia.
- Un árbol tiene masa y ocupa espacio, por lo que es materia.
- La luna
- Una idea para un nuevo invento
- La luna es materia.
- El invento en sí puede ser materia, pero la idea para él no lo es.
Solución
Ponte a prueba
¿Cuál de las siguientes cosas es materia y no es materia?
Respuesta

«Cubitos de hielo» de Darren Hester tiene licencia Creative Commons Attribution-Share Alike 2.5 Generic; «Glass of Water» de Greg Riegler tiene licencia Creative Commons Attribution 2.0 Generic; Tea Time by Vélocia is licensed under the Creative Commons Attribution-NonCommercial- NoDerivs 2.0 Generic.
Para entender la materia y cómo cambia, necesitamos ser capaces de describir la materia. Hay dos formas básicas de describir la materia: las propiedades físicas y las propiedades químicas. Las propiedades físicas son características que describen la materia tal y como existe. Algunas de las muchas características físicas de la materia son la forma, el color, el tamaño y la temperatura. Una propiedad física importante es la fase (o estado) de la materia. Las tres fases fundamentales de la materia son la sólida, la líquida y la gaseosa (ver Figura 1.1 «Las fases de la materia»).
Figura 1.2 Propiedades químicas
El hecho de que esta cerilla arda es una propiedad química de la cerilla.

«encender una cerilla» (http://commons.wikimedia.org/wiki/File:Match_stick,_encender_una_cerilla,_caja_de_cerillas,_fuego.JPG) by Jith JR is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported.
Las propiedades químicas son características de la materia que describen cómo cambia de forma la materia en presencia de otra materia. ¿Se quema una muestra de materia? La combustión es una propiedad química. ¿Se comporta de forma violenta cuando se pone en agua? Esta reacción también es una propiedad química (Figura 1.2 «Propiedades químicas»). En los siguientes capítulos, veremos cómo las descripciones de las propiedades físicas y químicas son aspectos importantes de la química.
Figura 1.3 Cambios físicos
El hielo sólido se funde en agua líquida-un cambio físico.

«Cubitos de hielo derritiéndose» (https://www.flickr.com/photos/jariceiii/5012344135/) by Jar is licensed under Creative Commons Attribution 2.0 Generic.
Si la materia permaneciera siempre igual, la química sería bastante aburrida. Afortunadamente, una parte importante de la química implica el cambio. Un cambio físico se produce cuando una muestra de materia cambia una o varias de sus propiedades físicas. Por ejemplo, un sólido puede fundirse (Figura 1.3 «Cambios físicos»), o el alcohol de un termómetro puede cambiar de volumen al variar la temperatura. Un cambio físico no afecta a la composición química de la materia.
Un cambio químico es el proceso de demostración de una propiedad química, como la cerilla que arde en la Figura 1.2 «Propiedades químicas». A medida que la materia de la cerilla se quema, su composición química cambia y se crean nuevas formas de materia con nuevas propiedades físicas. Tenga en cuenta que los cambios químicos suelen ir acompañados de cambios físicos, ya que la nueva materia probablemente tendrá propiedades físicas diferentes de la materia original.
Ejemplo 2
Describa cada proceso como un cambio físico o un cambio químico.
- El agua en el aire se convierte en nieve.
- El pelo de una persona se corta.
- La masa de pan se convierte en pan fresco en un horno.
Solución
- Debido a que el agua está pasando de una fase gaseosa a una fase sólida, esto es un cambio físico.
- Tu pelo largo se está acortando. Esto es un cambio físico.
- Debido a la temperatura del horno, se están produciendo cambios químicos en la masa del pan para hacer pan fresco. Estos son cambios químicos. (De hecho, gran parte de la cocina implica cambios químicos.)
- Un fuego está ardiendo en una chimenea.
- Se calienta el agua para hacer una taza de café.
- Cambio químico
- Cambio físico
Ponte a prueba
Identifica cada proceso como un cambio físico o un cambio químico.
Respuestas
Una muestra de materia que tiene las mismas propiedades físicas y químicas en todo momento se llama sustancia. A veces se utiliza la frase sustancia pura, pero la palabra pura no es necesaria. La definición del término sustancia es un ejemplo de cómo la química tiene una definición específica para una palabra que se utiliza en el lenguaje cotidiano con una definición diferente y más vaga. Aquí utilizaremos el término sustancia con su definición química estricta.
La química reconoce dos tipos diferentes de sustancias: elementos y compuestos. Un elemento es el tipo más simple de sustancia química; no puede descomponerse en sustancias químicas más simples por medios químicos ordinarios. Existen unos 115 elementos conocidos por la ciencia, de los cuales 80 son estables. (Los demás elementos son radiactivos, condición que consideraremos en el capítulo 15 «Química nuclear»). Cada elemento tiene su propio conjunto de propiedades físicas y químicas. Algunos ejemplos de elementos son el hierro, el carbono y el oro.
Un compuesto es una combinación de más de un elemento. Las propiedades físicas y químicas de un compuesto son diferentes de las propiedades físicas y químicas de sus elementos constitutivos; es decir, se comporta como una sustancia completamente diferente. Se conocen más de 50 millones de compuestos y cada día se descubren más. Algunos ejemplos de compuestos son el agua, la penicilina y el cloruro de sodio (el nombre químico de la sal de mesa común).
Los elementos y los compuestos no son las únicas formas en que puede presentarse la materia. Con frecuencia encontramos objetos que son combinaciones físicas de más de un elemento o compuesto. Las combinaciones físicas de más de una sustancia se llaman mezclas. Hay dos tipos de mezclas. Una mezcla heterogénea es una mezcla compuesta por dos o más sustancias. Es fácil saber, a veces a simple vista, que hay más de una sustancia presente. Una mezcla homogénea es una combinación de dos o más sustancias que está tan íntimamente mezclada que la mezcla se comporta como una sola sustancia. Otra palabra para designar una mezcla homogénea es solución. Así, una combinación de sal y lana de acero es una mezcla heterogénea porque es fácil ver qué partículas de la materia son cristales de sal y cuáles son lana de acero. En cambio, si se toman cristales de sal y se disuelven en agua, es muy difícil saber que hay más de una sustancia presente con sólo mirar, incluso si se utiliza un potente microscopio. La sal disuelta en agua es una mezcla homogénea, o una solución (Figura 1.4 «Tipos de mezclas»).

Ejemplo 3
Identifica las siguientes combinaciones como mezclas heterogéneas o mezclas homogéneas.
- Agua gaseosa (El dióxido de carbono está disuelto en el agua.)
- Mezcla de limaduras metálicas de hierro y polvo de azufre (Tanto el hierro como el azufre son elementos.)
- Porque el dióxido de carbono está disuelto en el agua, podemos inferir del comportamiento de los cristales de sal disueltos en el agua que el dióxido de carbono disuelto en el agua es (también) una mezcla homogénea.
- Suponiendo que el hierro y el azufre están simplemente mezclados, debería ser fácil ver qué es hierro y qué es azufre, por lo que se trata de una mezcla heterogénea.
- El cuerpo humano
- Una amalgama, una combinación de algunos otros metales disueltos en una pequeña cantidad de mercurio
- Mezcla heterogénea
- Mezcla homogénea
Solución
Ponte a prueba
¿Son las siguientes combinaciones mezclas homogéneas o heterogéneas?
Respuestas
Hay otros descriptores que podemos utilizar para describir la materia, especialmente los elementos. Normalmente podemos dividir los elementos en metales y no metales, y cada conjunto comparte ciertas propiedades (pero no siempre todas). Un metal es un elemento que es sólido a temperatura ambiente (aunque el mercurio es una excepción bien conocida), es brillante y plateado, conduce bien la electricidad y el calor, puede ser machacado en láminas finas (una propiedad llamada maleabilidad) y puede ser estirado en alambres finos (una propiedad llamada ductilidad). Un no metal es un elemento que es frágil cuando es sólido, no conduce muy bien la electricidad ni el calor y no puede convertirse en láminas finas o alambres (Figura 1.5 «Semimetales»). Los no metales también existen en una variedad de fases y colores a temperatura ambiente. Algunos elementos tienen propiedades tanto de los metales como de los no metales y se denominan semimetales (o metaloides). Veremos más adelante cómo estas descripciones pueden asignarse con bastante facilidad a varios elementos.
Figura 1.5 Semimetales

«Vertiendo mercurio líquido bionerd» está licenciado bajo la Creative CommonsAttribution 3.0 Unported; «Azufre-vulcano» por Heidi Soosalu está licenciado bajo la Creative Commons Attribution-Share Alike 3.0 Unported.
La figura 1.6 «Describiendo la materia» es un diagrama de flujo de las relaciones entre las diferentes formas de describir la materia.
Figura 1.6 Describiendo la materia
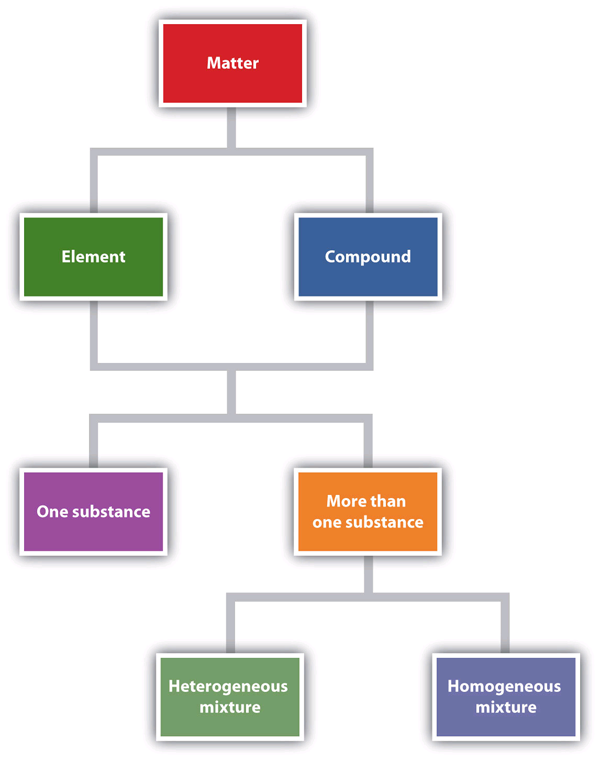
Este diagrama de flujo muestra cómo se puede describir la materia.
La química está en todas partes: Por la mañana
La mayoría de las personas tienen un ritual matutino, un proceso que realizan cada mañana para prepararse para el día. La química aparece en muchas de estas actividades.
- Si te duchas o bañas por la mañana, probablemente utilices jabón, champú o ambos. Estos artículos contienen sustancias químicas que interactúan con la grasa y la suciedad de tu cuerpo y tu pelo para eliminarlas y lavarlas. Muchos de estos productos también contienen sustancias químicas que te hacen oler bien; se llaman fragancias.
- Cuando te cepillas los dientes por la mañana, sueles utilizar pasta de dientes, una forma de jabón, para limpiar tus dientes. Los dentífricos suelen contener partículas diminutas y duras llamadas abrasivos que frotan físicamente los dientes. Muchas pastas de dientes también contienen flúor, una sustancia que interactúa químicamente con la superficie de los dientes para ayudar a prevenir las caries.
- Tal vez tome vitaminas, suplementos o medicamentos cada mañana. Las vitaminas y otros suplementos contienen sustancias químicas que su cuerpo necesita en pequeñas cantidades para funcionar correctamente. Los medicamentos son sustancias químicas que ayudan a combatir enfermedades y a promover la salud.
- Quizás preparas unos huevos fritos para desayunar. Freír huevos implica calentarlos lo suficiente como para que se produzca una reacción química que cocine los huevos.
- Después de comer, los alimentos que hay en el estómago reaccionan químicamente para que el cuerpo (sobre todo los intestinos) pueda absorber los alimentos, el agua y otros nutrientes.
- Si conduce o toma el autobús para ir a la escuela o al trabajo, está utilizando un vehículo que probablemente quema gasolina, un material que se quema con bastante facilidad y proporciona energía para impulsar el vehículo. Recuerda que la combustión es un cambio químico.
- La química es el estudio de la materia y sus interacciones con otra materia y energía.
- La materia es cualquier cosa que tenga masa y ocupe espacio.
- La materia puede describirse en términos de propiedades físicas y propiedades químicas.
- Las propiedades físicas y las propiedades químicas de la materia pueden cambiar.
- La materia está formada por elementos y compuestos.
- Las combinaciones de diferentes sustancias se llaman mezclas.
- Los elementos pueden describirse como metales, no metales y semimetales.
- Identifica cada uno como materia o no materia.
Estos son sólo algunos ejemplos de cómo la química influye en tu vida cotidiana. Y aún no hemos llegado a la comida!
Figura 1.7 La química en la vida real

«Jabones y champús» de Takashi Ota tiene una licencia de Creative Commons Attribution 2.0 Generic; «English Breakfast» es una traducción del inglés.0 Generic; «English Breakfast» está licenciado bajo Creative Commons Attribution-Share Alike 3.0 Unported; «Langley, Trans-Canada Highway» de James está licenciado bajo Creative Commons Attribution- Share Alike 3.0 Unported.

Fuente del vídeo: El mundo químico por keyj (https://viuvideos.viu.ca/media/The+Chemical+World/0_ixlxmwe8)
Claves para aprender
Ejercicios
a) un libro
b) el odio
c) la luz
d) un coche
e) un huevo frito
2. Pon un ejemplo de materia en cada fase: sólido, líquido o gas.
3. ¿Representa cada enunciado una propiedad física o una propiedad química?
a) El azufre es amarillo.
b) La lana de acero arde cuando se enciende con una llama.
c) Un galón de leche pesa más de dos kilos.
4. ¿Representa cada afirmación una propiedad física o una propiedad química?
a) Un montón de hojas se pudre lentamente en el patio trasero.
b) En presencia de oxígeno, el hidrógeno puede interactuar para hacer agua.
c) El oro puede estirarse en alambres muy finos.
5. Representa cada enunciado un cambio físico o un cambio químico?
a) El agua hierve y se convierte en vapor.
b) Los alimentos son convertidos en forma utilizable por el sistema digestivo.
c) El alcohol de muchos termómetros se congela a unos -40 grados Fahrenheit.
6. ¿Representa cada enunciado un cambio físico o un cambio químico?
a) El grafito, una forma de carbono elemental, puede convertirse en diamante, otra forma de carbono, a temperaturas y presiones muy altas.
b) La casa de enfrente se ha pintado de un nuevo color.
c) Los elementos sodio y cloro se unen para formar una nueva sustancia llamada cloruro de sodio.
7. Distinga entre un elemento y un compuesto. Aproximadamente, ¿cuántos se conocen de cada uno?
8. ¿Cuál es la diferencia entre una mezcla homogénea y una mezcla heterogénea?
9. Identifica cada una de ellas como una mezcla heterogénea o una mezcla homogénea.
a) La sal se mezcla con la pimienta.
b) El azúcar se disuelve en agua.
c) La pasta se cuece en agua hirviendo.
10. Identifica cada una de ellas como una mezcla heterogénea o una mezcla homogénea.
a) el aire
b) la suciedad
c) un televisor
11. En el Ejercicio 9, ¿qué opciones son también soluciones?
12. En el Ejercicio 10, ¿qué opciones son también soluciones?
13. ¿Por qué el hierro se considera un metal?
14. ¿Por qué el oxígeno se considera un no metal?
15. Distinga entre un metal y un no metal.
16. ¿Qué propiedades tienen los semimetales?
17. El carbono elemental es un sólido negro de aspecto apagado que conduce bien el calor y la electricidad. Es muy frágil y no se puede fabricar en láminas finas o en alambres largos. De estas propiedades, ¿cómo se comporta el carbono como metal? ¿Cómo se comporta el carbono como no metal?
18. El silicio puro es brillante y plateado pero no conduce bien la electricidad ni el calor. De estas propiedades, ¿cómo se comporta el silicio como metal? 19. ¿Cómo se comporta el silicio como no metal?
Respuestas
a) materia
b) no materia
c) no materia
d) materia
a) propiedad física
b) química propiedad
c) propiedad física
a) cambio físico
b) cambio químico
c) cambio físico
7. Un elemento es una parte química fundamental de una sustancia; hay unos 115 elementos conocidos. Un compuesto es una combinación de elementos que actúa como una sustancia diferente; hay más de 50 millones de sustancias conocidas.
b) homogénea
c) heterogénea
11. La opción b es una solución.
13. El hierro es un metal porque es sólido, es brillante y conduce bien la electricidad y el calor.
15. Los metales son típicamente brillantes, conducen bien la electricidad y el calor, y son maleables y dúctiles; los no metales tienen una variedad de colores y fases, son frágiles en la fase sólida, y no conducen bien el calor o la electricidad.
17. El carbono se comporta como un metal porque conduce bien el calor y la electricidad. Es un no metal porque es negro y quebradizo y no puede hacerse en láminas o alambres.