Los estereoisómeros tienen los mismos átomos o isótopos conectados por enlaces del mismo tipo, pero difieren en sus formas -las posiciones relativas de esos átomos en el espacio, aparte de las rotaciones y traslaciones
En teoría, se puede imaginar que cualquier disposición espacial de los átomos de una molécula o ion puede cambiarse gradualmente a cualquier otra disposición de infinitas maneras, moviendo cada átomo a lo largo de un camino apropiado. Sin embargo, los cambios en las posiciones de los átomos generalmente cambiarán la energía interna de una molécula, que viene determinada por los ángulos entre los enlaces de cada átomo y por las distancias entre los átomos (estén enlazados o no).
Un isómero conformacional es una disposición de los átomos de la molécula o del ion para la que la energía interna es un mínimo local; es decir, una disposición tal que cualquier pequeño cambio en las posiciones de los átomos aumentará la energía interna y, por tanto, dará lugar a fuerzas que tienden a empujar a los átomos de vuelta a las posiciones originales. El cambio de la forma de la molécula a partir de un mínimo de energía de este tipo A {\displaystyle {\ce {A}}

a otro mínimo energético B {{displaystyle {\ce {B}}


y B {displaystyle {\ce {B}}

. Es decir, un isómero de conformación está separado de cualquier otro isómero por una barrera energética: la cantidad que hay que añadir temporalmente a la energía interna de la molécula para pasar por todas las conformaciones intermedias por el camino más «fácil» (el que minimiza esa cantidad).

Un ejemplo clásico de isomerismo conformacional es el ciclohexano. Los alcanos generalmente tienen una energía mínima cuando el C – C – C {\displaystyle {\ce {C-C-C}}.


los ángulos deben estar lejos de ese valor (120 grados para un hexágono regular). Así, las conformaciones que son mínimos locales de energía tienen el anillo torcido en el espacio, según uno de los dos patrones conocidos como silla (con los carbonos alternativamente por encima y por debajo de su plano medio) y barco (con dos carbonos opuestos por encima del plano, y los otros cuatro por debajo).
Si la barrera energética entre dos isómeros conformacionales es lo suficientemente baja, puede ser superada por los aportes aleatorios de energía térmica que la molécula obtiene de las interacciones con el entorno o de sus propias vibraciones. En ese caso, los dos isómeros pueden considerarse también un único isómero, según la temperatura y el contexto. Por ejemplo, las dos conformaciones del ciclohexano se convierten la una en la otra con bastante rapidez a temperatura ambiente (en estado líquido), por lo que suelen tratarse como un único isómero en química.
En algunos casos, la barrera puede ser atravesada por el efecto túnel cuántico de los propios átomos. Este último fenómeno impide la separación de los estereoisómeros de la fluorocloramina NHFCl {\displaystyle {\ce {NHFCl}}.

o el peróxido de hidrógeno H 2 O 2 {displaystyle {\ce {H2O2}}

, porque las dos conformaciones con mínima energía se interconvierten en unos pocos picosegundos incluso a temperaturas muy bajas.
A la inversa, la barrera energética puede ser tan alta que la forma más fácil de superarla requeriría romper temporalmente y luego reformar o más enlaces de la molécula. En ese caso, los dos isómeros suelen ser lo suficientemente estables como para ser aislados y tratados como sustancias distintas. Se dice entonces que estos isómeros son diferentes isómeros configuracionales o «configuraciones» de la molécula, no sólo dos conformaciones diferentes. (Sin embargo, hay que tener en cuenta que los términos «conformación» y «configuración» son en gran medida sinónimos fuera de la química, y su distinción puede ser controvertida incluso entre los químicos.)
Las interacciones con otras moléculas del mismo o diferente compuesto (por ejemplo, a través de enlaces de hidrógeno) pueden cambiar significativamente la energía de las conformaciones de una molécula. Por lo tanto, los posibles isómeros de un compuesto en solución o en sus fases líquida y sólida pueden ser muy diferentes de los de una molécula aislada en el vacío. Incluso en la fase gaseosa, algunos compuestos como el ácido acético existirán sobre todo en forma de dímeros o grupos más grandes de moléculas, cuyas configuraciones pueden ser diferentes de las de la molécula aislada.
EnantiómerosEditar
Se dice que dos compuestos son enantiómeros si sus moléculas son imágenes especulares la una de la otra, que no pueden hacerse coincidir sólo mediante rotaciones o traslaciones – como una mano izquierda y una mano derecha. Se dice que las dos formas son quirales.
Un ejemplo clásico es el bromoclorofluorometano ( CHFClBr {\displaystyle {\ce {CHFClBr}}

). Los dos enantiómeros pueden distinguirse, por ejemplo, por si el camino F ⟶ Cl ⟶ Br {\displaystyle {\ce {F->Cl->Br}}.

El compuesto clorofluorometano CH 2 ClF {\displaystyle {\ce {CH2ClF}}

, en cambio, no es quiral: la imagen especular de su molécula también se obtiene mediante un medio giro alrededor de un eje adecuado.
Otro ejemplo de compuesto quiral es el 2,3-pentadieno H 3 C – CH = C = CH – CH 3 {\displaystyle {\ce {H3C-CH=C=CH-CH3}}.

un hidrocarburo que contiene dos dobles enlaces superpuestos. Los dobles enlaces son tales que los tres carbonos centrales están en línea recta, mientras que los tres primeros y los tres últimos se encuentran en planos perpendiculares. La molécula y su imagen en el espejo no son superponibles, aunque la molécula tenga un eje de simetría. Los dos enantiómeros pueden distinguirse, por ejemplo, por la regla de la mano derecha. Este tipo de isomería se denomina isomería axial.
Los enantiómeros se comportan de forma idéntica en las reacciones químicas, excepto cuando reaccionan con compuestos quirales o en presencia de catalizadores quirales, como la mayoría de las enzimas. Por esta última razón, los dos enantiómeros de la mayoría de los compuestos quirales suelen tener efectos y funciones notablemente diferentes en los organismos vivos. En bioquímica y ciencia de los alimentos, los dos enantiómeros de una molécula quiral -como la glucosa- suelen identificarse y tratarse como sustancias muy diferentes.
Cada enantiómero de un compuesto quiral suele rotar el plano de la luz polarizada que lo atraviesa. La rotación tiene la misma magnitud pero sentidos opuestos para los dos isómeros, y puede ser una forma útil de distinguir y medir su concentración en una solución. Por esta razón, los enantiómeros se denominaban antiguamente «isómeros ópticos». Sin embargo, este término es ambiguo y la IUPAC lo desaconseja.
Los estereoisómeros que no son enantiómeros se denominan diastereómeros. Algunos diastereómeros pueden contener centro quiral, otros no.
Algunos pares de enantiómeros (como los del trans-cicloocteno) pueden interconvertirse mediante movimientos internos que cambian las longitudes y los ángulos de los enlaces sólo ligeramente. Otros pares (como el CHFClBr) no pueden interconvertirse sin romper los enlaces, y por lo tanto son configuraciones diferentes.
Isomería cis-transEditar
Un doble enlace entre dos átomos de carbono obliga a los cuatro enlaces restantes (si son simples) a situarse en el mismo plano, perpendicular al plano del enlace definido por su orbital π. Si los dos enlaces de cada carbono se conectan a átomos diferentes, son posibles dos conformaciones distintas, que se diferencian entre sí por un giro de 180 grados de uno de los carbonos alrededor del doble enlace.
El ejemplo clásico es el dicloroeteno C 2 H 2 Cl 2 {\displaystyle {\ce {C2H2Cl2}}.


que tiene un cloro unido a cada carbono. Tiene dos isómeros conformacionales, con los dos cloros en el mismo lado o en lados opuestos del plano del doble enlace. Tradicionalmente se denominan cis (del latín que significa «en este lado de») y trans («en el otro lado de»), respectivamente; o Z y E en la nomenclatura recomendada por la IUPAC. La conversión entre estas dos formas suele requerir la ruptura temporal de enlaces (o la conversión del doble enlace en un enlace simple), por lo que ambas se consideran configuraciones diferentes de la molécula.
De forma más general, el isomerismo cis-trans (antes llamado «isomerismo geométrico») se produce en moléculas en las que la orientación relativa de dos grupos funcionales distinguibles está restringida por un marco algo rígido de otros átomos.
Por ejemplo, en el alcohol cíclico inositol ( CHOH ) 6 {\displaystyle {\ce {(CHOH)6}}


y el hidrógeno – H {displaystyle {\ce {-H}}

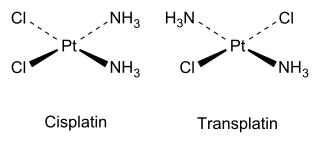
Los isómeros cis y trans también se dan en los compuestos de coordinación inorgánicos, como los MX 2 Y 2 cuadrados planares.


Para las moléculas orgánicas más complejas, las etiquetas cis y trans son ambiguas. La IUPAC recomienda un esquema de etiquetado más preciso, basado en las prioridades del PIC para los enlaces en cada átomo de carbono.
Centros con enlaces no equivalentesEditar
De forma más general, los átomos o grupos de átomos que pueden formar tres o más enlaces simples no equivalentes (como los metales de transición en los compuestos de coordinación) pueden dar lugar a múltiples estereoisómeros cuando se unen diferentes átomos o grupos en esas posiciones. Lo mismo ocurre si un centro con seis o más enlaces equivalentes tiene dos o más sustituyentes.
Por ejemplo, en el compuesto PF 4 Cl {\displaystyle {\ce {PF4Cl}}

Para el compuesto PF 3 Cl 2 {\displaystyle {\ce {PF3Cl2}}

Como otro ejemplo, un complejo con una fórmula como MX 3 Y 3 {\displaystyle {\ce {MX3Y3}}


(y por tanto también los tres enlaces Y {displaystyle {\ce {Y}})

) se dirigen a los tres ángulos de una cara del octaedro (isómero fac), o se encuentran en el mismo plano ecuatorial o «meridiano» del mismo (isómero mer).
Rotámeros y atropisómerosEditar
Dos partes de una molécula que están conectadas por un solo enlace pueden rotar alrededor de ese enlace. Mientras que el enlace en sí es indiferente a esa rotación, las atracciones y repulsiones entre los átomos de las dos partes normalmente hacen que la energía de toda la molécula varíe (y posiblemente también las dos partes se deformen) dependiendo del ángulo de rotación relativo φ entre las dos partes. Entonces habrá uno o varios valores especiales de φ para los que la energía se encuentre en un mínimo local. Las conformaciones correspondientes de la molécula se denominan isómeros rotacionales o rotámeros.
Así, por ejemplo, en una molécula de etano H 3 C – CH 3 {\displaystyle {\ce {H3C-CH3}}


eje. Por lo tanto, incluso si esos ángulos y distancias se suponen fijos, hay infinitas conformaciones para la molécula de etano, que difieren por el ángulo relativo φ de rotación entre los dos grupos. La débil repulsión entre los átomos de hidrógeno de los dos grupos metilo hace que la energía se minimice para tres valores específicos de φ, separados 120°. En esas configuraciones, los seis planos H – C – C {\displaystyle {\ce {H-C-C}}

o C – C – H {{displaystyle {\ce {C-C-H}}

están separados 60°. Descontando las rotaciones de toda la molécula, esa configuración es un único isómero, la llamada conformación escalonada.
Rotación entre las dos mitades de la molécula 1,2-dicloroetano ( ClH 2 C – CH 2 Cl {\displaystyle {\ce {ClH2C-CH2Cl}}


, Cl – Cl {displaystyle {\ce {Cl-Cl}}


interacciones. Por lo tanto, hay tres rotámeros: un isómero trans en el que los dos cloros están en el mismo plano que los dos carbonos, pero con enlaces dirigidos de forma opuesta; y dos isómeros gauche, imágenes especulares entre sí, en los que los dos – CH 2 Cl {\displaystyle {\ce {-CH2Cl}}

los grupos están girados unos 109° desde esa posición. La diferencia de energía calculada entre trans y gauche es de ~1,5 kcal/mol, la barrera para la rotación de ~109° de trans a gauche es de ~5 kcal/mol, y la de la rotación de ~142° de un gauche a su enantiómero es de ~8 kcal/mol. La situación para el butano es similar, pero con energías y barreras de gauche mucho más bajas.
Si las dos partes de la molécula conectadas por un solo enlace son voluminosas o están cargadas, las barreras energéticas pueden ser mucho mayores. Por ejemplo, en el compuesto bifenilo -dos grupos fenilo conectados por un enlace único- la repulsión entre los átomos de hidrógeno más cercanos al enlace único central da a la conformación totalmente plana, con los dos anillos en el mismo plano, una energía más alta que las conformaciones en las que los dos anillos están sesgados. En la fase gaseosa, la molécula tiene, por tanto, al menos dos rotámetros, con los planos de los anillos torcidos en ±47°, que son imágenes especulares entre sí. La barrera entre ellos es bastante baja (~8 kJ/mol). Este efecto de impedimento estérico es más pronunciado cuando esos cuatro hidrógenos se sustituyen por átomos o grupos más grandes, como cloros o carboxilos. Si la barrera es lo suficientemente alta como para que los dos rotámeros se separen como compuestos estables a temperatura ambiente, se denominan atropisómeros.
TopoisómerosEditar
Las moléculas grandes pueden tener isómeros que se diferencian por la topología de su disposición global en el espacio, aunque no haya ninguna restricción geométrica específica que los separe. Por ejemplo, las cadenas largas pueden retorcerse para formar nudos topológicamente distintos, impidiéndose la interconversión mediante sustituyentes voluminosos o el cierre de ciclos (como en los plásmidos circulares de ADN y ARN). Algunos nudos pueden presentarse en pares de enantiómeros de imagen especular. Tales formas se denominan isómeros topológicos o topoisómeros
Además, dos o más moléculas de este tipo pueden estar unidas en un catenano por tales enlaces topológicos, aunque no haya ningún enlace químico entre ellas. Si las moléculas son lo suficientemente grandes, el enlace puede producirse de múltiples formas topológicamente distintas, constituyendo diferentes isómeros. Los compuestos jaula, como el helio encerrado en dodecaedros (He@C
20H
20) y los peápodos de carbono, son un tipo similar de isomería topológica que implica a moléculas con grandes vacíos internos con aberturas restringidas o inexistentes.