Informe de un caso
Manejo del endometrio proliferativo en la biopsia en mujeres posmenopáusicas
Sidharth Srinivas1, Sachchidananda Maiti2, Perunkulam Jothilakshmi2
1Escuela de Medicina de Manchester, University of Manchester, Manchester, Reino Unido
2Obstetricia & Ginecología, The Pennine Acute NHS Hospitals, Crumpsall, Reino Unido
Dirección de correo electrónico:
 (S. Srinivas)
(S. Srinivas) Para citar este artículo:
Sidharth Srinivas, Sachchidananda Maiti, Perunkulam Jothilakshmi. Manejo del endometrio proliferativo en la biopsia en mujeres posmenopáusicas. Journal of Gynecology and Obstetrics. Vol. 4, nº 6, 2016, pp. 38-43. doi: 10.11648/j.jgo.20160406.12
Recibido: 4 de septiembre de 2016; Aceptado: 21 de septiembre de 2016; Publicado: 15 de octubre de 2016
Resumen: El sangrado posmenopáusico (SPM) suele estar causado por varias afecciones endometriales (hiperplasia y carcinoma) para las que existen tratamientos basados en la evidencia. Sin embargo, hay poca literatura y no hay tratamientos basados en la evidencia para un hallazgo de endometrio proliferativo sin atipia en la biopsia endometrial de Pipelle en mujeres que presentan PMB. Nuestro objetivo es explorar las opciones de gestión y tratamiento para este subconjunto de mujeres. Se trata de una revisión retrospectiva y observacional de una serie de casos de mujeres que acudieron a una clínica de acceso rápido de ginecología en un Hospital General de Distrito de Manchester, Reino Unido, durante un período de tres semanas. Se eligieron cuatro mujeres a las que se les encontró un endometrio proliferativo o secretor en la biopsia de Pipelle endometrial. A continuación se analizaron sus antecedentes, los resultados de la exploración, las investigaciones, el tratamiento y los resultados del seguimiento. Esta serie de casos ha identificado el dilema de gestión que plantean las pacientes con endometrio proliferativo sin atipia en el muestreo endometrial. Las cuatro pacientes fueron seguidas con una repetición de la biopsia endometrial Pipelle seis semanas después de su presentación en la unidad de ginecología especializada. Posteriormente, se les aconsejó o se les trató con terapia de progesterona oral durante seis a ocho semanas. Las opciones de tratamiento incluían el sistema intrauterino (SIU) Mirena, la terapia de progesterona oral y el alta de la paciente en atención primaria. No hay consenso sobre la importancia de la progesterona oral o la duración del seguimiento necesario para vigilar el desarrollo de hiperplasia endometrial o cáncer en este subconjunto de pacientes. Se necesita más investigación para desarrollar directrices de gestión basadas en la evidencia para el endometrio proliferativo en mujeres con PMB.
Palabras clave: Sangrado posmenopáusico, endometrio proliferativo sin atipia, terapia con progesterona
1. Introducción
La hemorragia posmenopáusica es una presentación importante y común en la clínica ginecológica. Es necesario realizar investigaciones urgentes para descartar el cáncer de endometrio, la neoplasia ginecológica más frecuente en el Reino Unido . Las causas benignas, como la vaginitis atrófica, los pólipos y los fibromas, también pueden causar un estrés importante a la paciente. Un diagnóstico histológico de hiperplasia endometrial aumenta el riesgo de malignidad y se requiere tratamiento para inducir la regresión. Por el contrario, un diagnóstico histológico de endometrio proliferativo sin células atípicas deja a los clínicos sin un tratamiento basado en la evidencia y la incertidumbre en cuanto a su potencial de transformación maligna.
En este informe hemos analizado cuatro casos de PMB cuyas investigaciones encontraron endometrio proliferativo en la histología. Esta serie de casos es de interés porque hay escasa evidencia en la literatura sobre el endometrio proliferativo en mujeres posmenopáusicas que presentan un síntoma de PMB, y como resultado no hay un tratamiento basado en la evidencia. Este informe identificará las áreas de incertidumbre en nuestra comprensión y manejo de estos pacientes.
Métodos
Se trata de una serie de casos retrospectiva y observacional que analiza a las mujeres que se presentan con PMB en una clínica de acceso rápido (RAC) de ginecología en un Hospital General de Distrito en Manchester durante un período de 3 semanas en noviembre de 2014. Se eligieron al azar cuatro pacientes que tenían endometrio proliferativo o secretor en el muestreo endometrial con un dispositivo Pipelle. Todas las mujeres posmenopáusicas de esta serie de casos fueron remitidas con urgencia a la atención secundaria tras experimentar al menos un episodio de sangrado. En esta serie de casos, se incluyeron mujeres de todas las edades que habían pasado por la menopausia natural. Se utilizaron las notas del caso para analizar la historia de cada paciente, los hallazgos del examen, las investigaciones, el tratamiento y el seguimiento.
2. Serie de casos
Tabla 1. Aspectos relevantes de la historia de la paciente.
| Edad & Estado menopáusico. | Motivo de la derivación | Síntomas asociados | Antecedentes médicos | Contracepción, HRT &Estado de tamoxifeno | Historia de citologías cervicales | |
| 1 | 54, postmenopáusica desde hace 2 años | Dos episodios de sangrado abundante durante cinco días cada uno | Molestias abdominales molestias | Nada | Nada | Normal & hasta-hasta la fecha |
| 2 | 59, posmenopáusica desde hace 5 años | Diez días de sangrado vaginal abundante con coágulos | Molestias abdominales bajas y pérdida de peso | Diabetes mellitus tipo 2, hipertensión y cálculos biliares | &
Normalhasta la fecha
|
|
| 3 | 52, posmenopáusica 1 año | Endometrio irregularmente grueso en la ecografía de atención primaria | Sangrado intermitente con coágulos e inundaciones | Cáncer de mama, mastectomía bilateral y vaciado de ganglios axilares | Mirena IUS y Tamoxifeno hace un año | Normal & hasta-hasta la fecha | 4 | 59, posmenopáusica | Ocho días de sangrado vaginal ligero continuo | Dolor abdominal leve | Hipertensión, hipertiroidismo, índice de masa corporal elevado | Nada |
Tabla 2. Resultados de la investigación y tratamiento.
|
Paciente
|
Examen pélvico & TVUS | Histeroscopia | Biopsia de pipela | Repite biopsia pipelle | Tratamiento | Duración del seguimientoseguimiento |
| 1 | Normal & 1.3mm | No se realiza | Endometrio proliferativo sin atipias ni malignidad | Endometrio secretor sin atipia ni malignidad | MDPA 100mg BD durante 6 a 8 semanas | 6 semanas |
| 2 | Normal & 10mm | Normal aparte de 2.Pólipo polipoidal de 5mm | Entrepierna secretoria sin atipia ni malignidad | Entrepierna proliferativa endometrio sin atipia o malignidad | Asesoramiento sobre el SIU de Mirena | 6 semanas | 3 | Normal & 2mm | No se realiza | Entrepierna proliferativa sin atipia ni malignidad | Entrepierna proliferativa sin atipia ni malignidad | Nada | 8 semanas |
| 4 | Normal & 10mm | Normal aparte de un pequeño pólipo | Proliferativo endometrio sin atipia ni malignidad | Entometrio proliferativo sin atipia ni malignidad | MDPA 100mg BD durante 6 a 8 semanas | 8 semanas |
3. Discusión
3.1. Cambios endometriales durante la menopausia
Un endometrio que se atrofia y pierde su capa funcional, con un estroma endometrial que se vuelve fibroso y glándulas que no muestran actividad proliferativa ni secretora – es la imagen aceptada del endometrio posmenopáusico . Esta regresión endometrial coincide con el cese de la menstruación, por lo que cuando se produce una hemorragia hay que descartar una patología. La fisiología del endometrio posmenopáusico y su papel en la patología pélvica ha despertado interés en las últimas décadas, con especial atención a los precursores del carcinoma endometrial. Sin embargo, existe mucha menos literatura sobre el endometrio posmenopáusico en comparación con el endometrio durante la vida reproductiva.
En general, los estudios han demostrado que tres cuartas partes de las mujeres posmenopáusicas parecen tener el endometrio atrofiado con diversos grados de glándulas quísticas dilatadas. Otro 15% tiene pólipos endometriales compuestos por glándulas quísticas. El 10% restante presenta un endometrio con proliferación e hiperplasia. La atrofia endometrial se observa durante el primer año de la menopausia y su incidencia se mantiene constante a lo largo de la misma. En contraste con los casos de proliferación e hiperplasia que se observan principalmente en los primeros 5 años después de la menopausia.
En 1954 McBride analizó el endometrio posmenopáusico en un gran estudio; tomando muestras mediante legrado de 1.521 pacientes en varios períodos después de la menopausia. En 1.315 muestras se obtuvo poco material, salvo mucosa, mientras que los 206 casos restantes mostraban los siguientes patrones endometriales: atrofia, glándula quística única o difusa, hiperplasia, proliferación, pólipos secretores y fibroadenomatosos. Los resultados sugieren que la incidencia del endometrio proliferativo o secretor es del 6,3%. Sin embargo, el autor propone que, en los casos en que no se obtuvo ninguna muestra, el endometrio estaba inactivo o atrofiado. Según esta hipótesis, la incidencia del endometrio proliferativo o secretor es del 0,8%. Esto nos lleva a pensar que la verdadera incidencia de un endometrio proliferativo o secretor se encuentra entre el 6,3% y el 0,9%.
Un estudio que investigó las biopsias de endometrio de mujeres peri y posmenopáusicas en tratamiento continuo con THS encontró que la mayoría de los endometrios son atróficos (68,7%) o proliferativos (23,5%). Mientras que el 0,6% mostraba una hiperplasia simple sin atipia, el 0,5% tenía un endometrio secretor y se encontró un adenocarcinoma bien diferenciado en el 0,07% de los casos. Esto sugiere que las mujeres posmenopáusicas que reciben estimulación hormonal tienen una mayor incidencia de endometrio proliferativo.
3.2. Causas de la hemorragia posmenopáusica
La hemorragia posmenopáusica se refiere a cualquier sangrado vaginal en una mujer posmenopáusica que no es la hemorragia cíclica esperada que se produce con la terapia hormonal sustitutiva secuencial . El sangrado postmenopáusico justifica una remisión urgente a ginecología, ya que el 10% de estas pacientes tienen cáncer de endometrio. El diagnóstico precoz del cáncer de endometrio es importante para reducir la diseminación local y maligna y se asocia con una supervivencia de hasta el 90%. El cáncer de endometrio suele presentarse de forma precoz con el PMB, aunque son frecuentes la vaginitis atrófica y las lesiones benignas, como los pólipos y los fibromas. Un estudio encontró que hasta el 30% de los casos de PMB revelan una anormalidad anatómica subyacente (ver tabla 3).
Tabla 3. Las causas anatómicas del sangrado posmenopáusico.
| Endometrio | Cervix | Vagina | Ovario |
| Fibromas | Pólipos | Vaginitis atrófica | Cáncer |
| Hiperplasia | Cáncer | Cáncer | |
| Pólipos | |||
| Cáncer | |||
| Endometritis |
3.3. Investigación de la hemorragia posmenopáusica
De acuerdo con las directrices del Instituto Nacional de Excelencia Clínica (NICE), tres de las pacientes de nuestra serie de casos que presentaban una hemorragia posmenopáusica, y que no recibían THS, fueron remitidas a atención secundaria para descartar un cáncer. Todas estas pacientes fueron atendidas en un plazo de 2 semanas en una clínica de ginecología, cumpliendo el objetivo nacional de derivación urgente.
Las pacientes en tratamiento con THS son más complejas, ya que puede ser difícil diferenciar entre un sangrado cíclico normal y uno irregular. El sangrado uterino o el manchado al iniciar la THS es común pero debería cesar después de 6 meses . Sin embargo, el NICE recomienda una derivación urgente para el sangrado posmenopáusico persistente o inexplicable después de la interrupción de la THS durante 6 semanas.
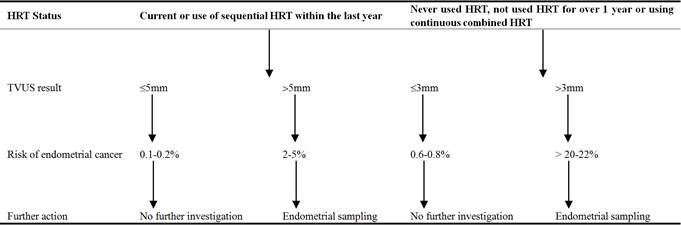
La Red de Directrices Intercolegiales de Escocia (SIGN) ofrece un algoritmo para la investigación del PMB (ver tabla 4). De acuerdo con estas directrices, las cuatro pacientes fueron sometidas a un examen pélvico para buscar cualquier causa benigna de sangrado, como ectropión cervical, pólipos o para levantar la sospecha de malignidad. Resulta valioso realizar una anamnesis exhaustiva en la que se identifiquen los factores de riesgo de cáncer de endometrio, como los antecedentes de anovulación crónica, obesidad, diabetes, uso de estrógenos o tamoxifeno y síndromes genéticos. Además, un examen con espéculo permite a los clínicos experimentados diagnosticar lesiones vulvares, vaginales y cervicales. Una anamnesis y una exploración minuciosas también pueden hacer sospechar de causas poco frecuentes de hemorragia vaginal, como los trastornos de la coagulación y la leucemia.
Según las recomendaciones de SIGN, la ETV fue la investigación de primera línea que se utilizó para las mujeres que presentaban un PMB en nuestra serie de casos. Su base de evidencia, conveniencia y ausencia de complicaciones la convierten en una investigación ideal para evaluar a las pacientes con mayor riesgo de cáncer. Cuando el endometrio es más grueso, el riesgo de patología, como la malignidad, aumenta, lo que justifica una investigación adicional. Mientras que las mujeres con un endometrio delgado pueden ser tranquilizadas y volver a ser llamadas para nuevas investigaciones sólo si el sangrado persiste . El establecimiento del valor de corte del grosor del endometrio equilibra la necesidad de identificar todas las patologías siniestras y minimiza el uso excesivo de recursos. Fijar el punto de corte en 3 mm garantiza una alta sensibilidad (100%), pero compromete la especificidad (25,8%) de la investigación, lo que da lugar a un número excesivo de pacientes investigadas. En la actualidad, en la práctica clínica se utilizan 4 mm, ya que se considera que ofrecen una sensibilidad (91,6%) y una especificidad (44,5%) óptimas.
Existen otras formas de ultrasonografía, como el doppler transvaginal, la tridimensional, la realzada con solución salina y la medición de la textura endometrial y el análisis de los márgenes. Sin embargo, los estudios no han demostrado sus ventajas sobre la ecografía transvaginal y actualmente no se recomiendan ni se utilizan en la práctica clínica rutinaria
La inspección directa y la toma de muestras de tejido endometrial se consideran el estándar de oro y la segunda línea de investigación en esta cohorte de pacientes. La práctica actual y las directrices de SIGN recomiendan el uso de dispositivos de biopsia endometrial para investigar más a fondo a las pacientes que se consideran de mayor riesgo de cáncer de endometrio. Convencionalmente se utilizaba el legrado por dilatación & para investigar las hemorragias anormales, pero ahora la evidencia apoya el uso de dispositivos de muestreo endometrial como el dispositivo Pipelle, utilizado en las cuatro pacientes de mi serie de casos. Tiene una tasa de detección del 99,6% para el cáncer de endometrio en mujeres posmenopáusicas, así como una alta sensibilidad (81%) y especificidad (98%) para identificar la hiperplasia atípica. En resumen, la combinación de la ETV y la biopsia endometrial de Pipelle ofrece suficiente información diagnóstica para diagnosticar o descartar la enfermedad endometrial benigna y maligna.
Las pacientes en tratamiento con tamoxifeno tienen una incidencia de cáncer de endometrio de tres a seis veces mayor, y el NICE recomienda la derivación urgente de estas mujeres que se quejan de PMB. Se ha demostrado que el riesgo de cáncer y proliferación, debido al débil efecto estrogénico del tamoxifeno, aumenta con el aumento de la dosis y la duración del tratamiento. La paciente 3 de nuestra serie de casos, una mujer de 59 años que tomaba tamoxifeno, fue investigada más ampliamente mediante histeroscopia, además de una ecografía TV y una biopsia Pipelle. Esto está en consonancia con las directrices que sugieren que la histeroscopia con biopsia es preferible a la ETV, ya que la interpretación de la ultrasonografía se ve dificultada por el engrosamiento del endometrio en pacientes que toman tamoxifeno.
Tabla 4. Mujeres que presentan una hemorragia posmenopáusica (y que no toman tamoxifeno).
3.4. Hiperplasia endometrial
El diagnóstico de hiperplasia endometrial (EH) se realiza en aproximadamente el 10% de las mujeres que presentan PMB . La Organización Mundial de la Salud (OMS) clasifica la hiperplasia endometrial en tipos simples y complejos; cada tipo se clasifica a su vez en función de la presencia o ausencia de atipia nuclear. Las mujeres que presentan atipia (véase la figura 2) en la biopsia endometrial deben ser investigadas más a fondo, ya que aproximadamente el 50% tienen carcinoma endometrial concurrente. Además, el riesgo de progresión a cáncer aumenta en presencia de atipia (27,5% a los 9 años del diagnóstico), pero es mucho menor en el caso de la hiperplasia sin atipia (4,6% a los 9 años del diagnóstico) . Dada la probabilidad de una futura malignidad, se recomienda la histerectomía con salpingo-ooforectomía bilateral en las mujeres posmenopáusicas con EH en presencia de atipia. En ausencia de células atípicas, las mujeres pueden ser manejadas con progestinas y biopsias seriadas cada 6 meses para asegurar la respuesta al tratamiento. Las progestinas más utilizadas son el acetato de megestrol y el acetato de medroxiprogesterona. Aunque las cuatro pacientes de nuestra serie de casos no tienen hiperplasia endometrial, se puede postular que si se hubieran encontrado células atípicas, el riesgo de malignidad y la necesidad de más investigaciones habría aumentado en las pacientes con endometrio proliferativo o secretor.
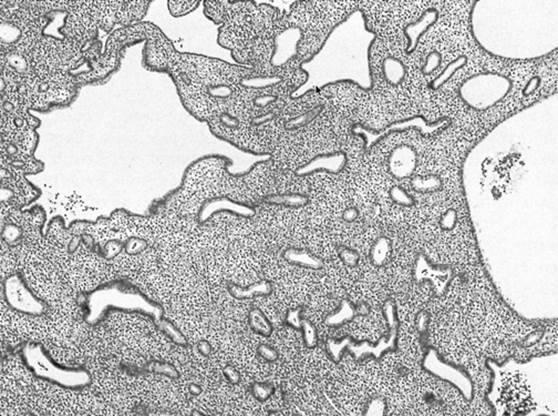
Figura 1. Una biopsia endometrial que muestra una hiperplasia endometrial simple, con glándulas endometriales distribuidas irregularmente y ampliamente separadas por un estroma hiperplásico.
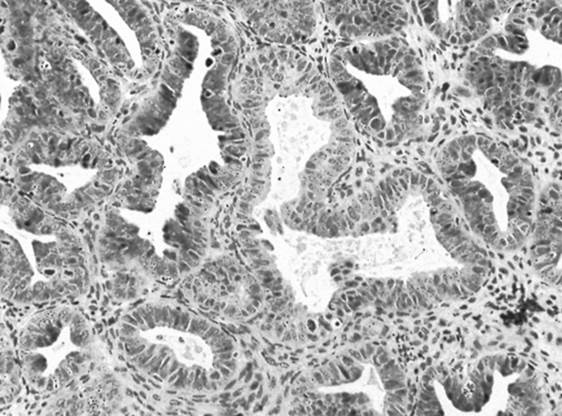
Figura 2. Una biopsia endometrial que muestra una hiperplasia endometrial con células glandulares atípicas .
3.5. Patogénesis del endometrio proliferativo
Mi informe ha identificado a mujeres posmenopáusicas cuyas biopsias imitaban el endometrio encontrado en el ciclo menstrual mensual de una mujer reproductiva. El aumento de la actividad mitótica del epitelio estromal, acompañado de una hiperplasia celular y un aumento de la matriz extracelular, da lugar a un engrosamiento del endometrio durante la fase proliferativa del mismo (véase la figura 3). Esta proliferación es estimulada por los estrógenos secretados por los folículos en desarrollo durante el ciclo menstrual. La progesterona se opone a las acciones de los estrógenos y sus efectos detienen la fase proliferativa del ciclo endometrial. La progesterona induce la fase secretora estimulando las glándulas endometriales y aumentando la vascularidad (véase la figura 4). El grosor del endometrio aumenta aún más a medida que las glándulas, las células del estroma y los vasos sanguíneos se engrosan. En las mujeres posmenopáusicas, se cree que los bajos niveles de estrógenos y progesterona procedentes de fuentes extrafoliculares estimulan la proliferación del endometrio. Además, los fitoestrógenos, como las semillas oleaginosas, los productos de soja y el tofu, son sustancias vegetales estructural y funcionalmente similares al estradiol. A pesar de los estudios que sugieren que los fitoestrógenos no inducen la proliferación ni aumentan el riesgo de cáncer de endometrio, sus efectos a largo plazo son relativamente desconocidos. Del mismo modo, existe incertidumbre en torno al uso sin receta del cohosh negro, un remedio a base de hierbas con posibles efectos proliferativos en el endometrio.
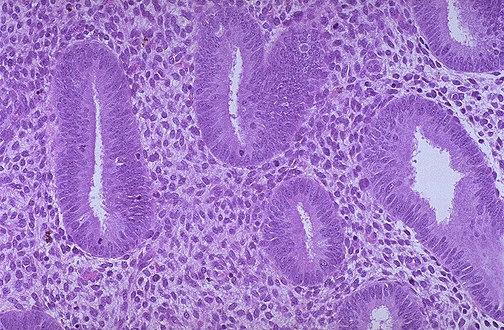
Figura 3. Aspecto microscópico del endometrio proliferativo, con proliferación de glándulas tubulares y estroma denso.
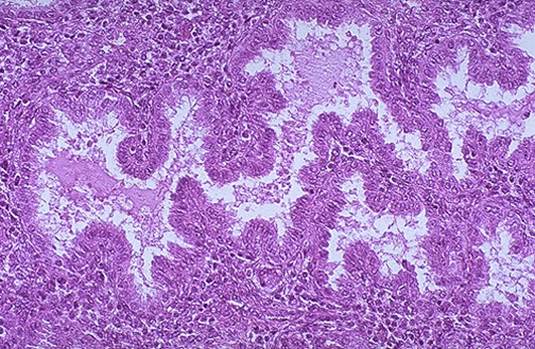
Figura 4. Aspecto microscópico del endometrio secretor y grandes glándulas tortuosas llenas de secreciones .
Los estudios han demostrado que el endometrio proliferativo no es infrecuente y también sugieren que los cánceres del endometrio se originan a partir de un fondo de actividad proliferativa y no de inercia . Sin embargo, la probabilidad de que un endometrio proliferativo simple se transforme en un tumor maligno es muy baja y significativamente menor que el riesgo del 0,3 al 1% de que la hiperplasia endometrial se convierta en cáncer. Sin embargo, los factores de riesgo son el aumento del índice de masa corporal y la edad. Ambos están asociados a la aromatización periférica y a comorbilidades comunes entre las pacientes con cáncer de endometrio.
3.6. Manejo del endometrio proliferativo
No hay estudios publicados, hasta donde sabemos, que analicen el manejo de la proliferación endometrial sin atipia en la hemorragia posmenopáusica. Como resultado, actualmente no existe un tratamiento basado en la evidencia para estas mujeres. Tampoco hay consenso sobre la dosis y la duración recomendadas del tratamiento con MDPA en este subconjunto de pacientes. Además, no hay acuerdo sobre la frecuencia de seguimiento necesaria para descartar patologías proliferativas endometriales más siniestras.
Existen algunas escuelas de pensamiento entre los ginecólogos sobre la mejor manera de tratar a estas pacientes. Como se supone que el riesgo de que el endometrio proliferativo se transforme en cáncer es muy bajo, una opción es tranquilizar a la paciente antes de darle el alta en atención primaria. Por otro lado, un enfoque más conservador implica el uso de una terapia sistémica con progesterona para inducir la regresión del endometrio. El acetato de medroxiprogesterona oral puede prescribirse durante un periodo relativamente corto (de seis a ocho semanas en nuestra serie de casos) para inducir la regresión del endometrio. Los beneficios del tratamiento con progesterona deben sopesarse cuidadosamente con sus efectos secundarios, como el riesgo de trombosis venosa profunda. Una opción a más largo plazo que están considerando algunos ginecólogos es el sistema intrauterino Mirena, una forma de anticoncepción reversible de acción prolongada que adelgaza el endometrio liberando progesterona en el útero. Estas dos formas de progesterona se utilizan también en la hiperplasia endometrial y se ha demostrado que protegen el endometrio de la proliferación y la transformación maligna. El SIU Mirena está autorizado para proporcionar protección endometrial durante 4 años. La segunda paciente de nuestra serie de casos fue iniciada en la terapia con progesterona después de que una biopsia Pipelle encontrara endometrio proliferativo, mientras que la cuarta paciente fue iniciada en el mismo tratamiento después de la confirmación de la histología con la repetición de la biopsia Pipelle. Debido a la falta de pruebas, no se sabe si es necesario repetir la biopsia para confirmar los hallazgos o si una sola biopsia es suficiente para el tratamiento. También encontramos que las pacientes de nuestra serie de casos estaban siendo tratadas con medroxiprogesterona oral durante 6 a 8 semanas, pero ningún estudio que conozcamos ha analizado la duración ideal del tratamiento. Un enfoque más radical para tratar el endometrio proliferativo sería una histerectomía para los episodios repetidos de PMB para eliminar cualquier riesgo de transformación en carcinoma endometrial. Sin embargo, los riesgos anestésicos y operatorios y el impacto psicológico hacen que sea el último recurso. Se organizó un seguimiento y una repetición de la biopsia endometrial Pipelle en 6 semanas para tres de las cuatro pacientes. Sin embargo, no hay pruebas sobre la frecuencia del seguimiento o la evaluación de la respuesta al tratamiento. Además, no está claro si los factores de riesgo, como el IMC elevado y el cáncer de mama, deberían reducir el umbral para ofrecer la repetición de la biopsia de Pipelle.
4. Conclusión
Este informe ha identificado las tendencias actuales en el manejo del endometrio proliferativo con medroxiprogesterona oral. Se han destacado múltiples áreas de incertidumbre como la duración del tratamiento y el seguimiento. Se necesita más investigación sobre el endometrio proliferativo en el PMB con el fin de desarrollar directrices de tratamiento basadas en la evidencia.
- UK CR. Cancer Statistics: Registrations Series. 2011.
- McBride. El endometrio normal posmenopáusico. J Obstet Gynaecol Br Emp 1954;61 (5):691-7.
- Noer T. The histology of the senile endometrium. Acta Pathologica Microbiologica Scandinavica 1961;51 (3):193.
- Korhonen MO, Symons JP, Hyde BM, Rowan JP, Wilborn WH. Clasificación histológica y hallazgos patológicos de las muestras de biopsia endometrial obtenidas de 2964 mujeres perimenopáusicas y posmenopáusicas sometidas a cribado de hormonas continuas como terapia de sustitución (Estudio CHART 2). American Journal of Obstetrics and Gynecology 1997;176 (2):377.
- Goldstein RB, Bree RL, Benson CB, Benacerraf BR, Bloss JD, Carlos R, et al. Evaluation of the woman with postmenopausal bleeding: Declaración de la Conferencia de Consenso patrocinada por la Sociedad de Radiólogos en Ultrasonido. J Ultrasound Med 2001;20 (10):1025-36.
- SIGN. Investigación de la hemorragia posmenopáusica. 2002.
- Paley PJ. Cribado de las principales enfermedades malignas que afectan a las mujeres: Directrices actuales. American journal of obstetrics and gynecology 2001;184 (5):1021.
- NICECG27. Guías de derivación para la sospecha de cáncer. 2005.
- Nand SL, Webster MA, Baber R, O’Connor V. Bleeding pattern and endometrial changes during continuous combined hormone replacement therapy. El grupo de estudio Ogen/Provera. Obstet Gynecol 1998;91 (5 Pt 1):678-84.
- Davidson KG, Dubinsky TJ. Ultrasonographic evaluation of the endometrium in postmenopausal vaginal bleeding. Radiol Clin North Am 2003;41 (4):769-80.
- Gupta JK, Chien PFW, Voit D, Clark TJ, Khan KS. Espesor endometrial ultrasonográfico para el diagnóstico de la patología endometrial en mujeres con sangrado posmenopáusico: un metaanálisis. Acta Obstetricia et Gynecologica Scandinavica 2002;81 (9):799.
- Dijkhuizen FPHLJ, BrÃ-Lmann HAM, Potters AE, Bongers MY, Heintz APM. La precisión de la ecografía transvaginal en el diagnóstico de las anomalías endometriales. Obstetrics & Gynecology 1996;87 (3):345-349.
- Ciatto S, Cecchini S, Gervasi G, Landini A, Zappa M, Crocetti E. Surveillance for endometrial cancer with transvaginal ultrasonography of breast cancer patients under tamoxifen treatment. Br J Cancer 2003;88 (8):1175-9.
- Weber G, Mere E, Bahlmanw E, Riisch B. Evaluation of different transvaginal sonographic diagnostic parameters in women with postmenopausal bleeding. Ultrasound in Obstetrics and Gynecology 1998;12 (4):265.
- Gruboeck K, Jurkovic D, Lawton F, Savvas M, Tailor A, Campbell S. The diagnostic value of endometrial thickness and volume measurements by three-dimensional ultrasound in patients with postmenopausal bleeding. Ultrasound in Obstetrics and Gynecology 1996;8 (4):272.
- Dijkhuizen FPHLJ, Mol BWJ, Brölmann HAM, Heintz APM. La precisión del muestreo endometrial en el diagnóstico de pacientes con carcinoma e hiperplasia endometrial. Cancer 2000;89 (8):1765.
- Van den Bosch T, Vandendael A, Van Schoubroeck D, Wranz PA, Lombard CJ. Combinación de la ecografía vaginal y el muestreo endometrial en la oficina en el diagnóstico de la enfermedad endometrial en mujeres posmenopáusicas. Obstet Gynecol 1995;85 (3):349-52.
- Curtis RE, Boice JD, Shriner DA, Hankey BF, Fraumeni JF. Segundos cánceres después de la terapia adyuvante con tamoxifeno para el cáncer de mama. Journal of the National Cancer Institute 1996;88 (12):832-835.
- Karlsson B, Granberg S, Wikland M, Torvid K, Marsal K, et al. Transvaginal ultrasonography of the endometrium in women with postmenopausal bleeding âa Nordic multicenter study. American Journal of Obstetrics and Gynecology 1995;172 (5):1488.
- Lacey JV, Chia VM. Hiperplasia endometrial y riesgo de progresión a carcinoma. Maturitas 2009;63 (1):39.
- Lacey JV, Sherman ME, Rush BB, Ronnett BM, Ioffe OB, Duggan MiA, et al. Absolute Risk of Endometrial Carcinoma During 20-Year Follow-Up Among Women With Endometrial Hyperplasia. Journal of Clinical Oncology 2010;28 (5):788-792.
- Silverberg. Tumores del cuerpo uterino y enfermedad trofoblástica gestacional. AFIP Atlas of Tumor Pathology 1995.
- Balk JL, Whiteside DA, Naus G, DeFerrari E, Roberts JM. Un estudio piloto de los efectos de la suplementación con fitoestrógenos en el endometrio posmenopáusico. J Soc Gynecol Investig 2002;9 (4):238-42.
- Patología FG. http://library.med.utah.edu/WebPath/FEMHTML/FEMIDX.html#2.
- Sivridis E, Giatromanolaki A. Proliferative activity in postmenopausal endometrium: the lurking potential for giving rise to an endometrial adenocarcinoma. J Clin Pathol 2004;57 (8):840-4.
- Baak JP, Wisse-Brekelmans EC, Fleege JC, van der Putten HW, Bezemer PD. Evaluación del riesgo de cáncer de endometrio en la hiperplasia, mediante características morfológicas y morfométricas. Pathol Res Pract 1992;188 (7):856-9.
- Wan YL, Holland C. The efficacy of levonorgestrel intrauterine systems for endometrial protection: a systematic review. Climacteric;14 (6):622-632.