PED seroso en DMAE
El desprendimiento del epitelio pigmentario retiniano (PED) forma parte del espectro clínico de la degeneración macular asociada a la edad (DMAE).
Sin embargo, se han descrito diferentes tipos de PED en la literatura y se han relacionado o no con la DMAE.
El PED seroso se define como un área de elevación serosa del epitelio pigmentario de la retina (EPR), claramente delimitada y con forma de cúpula. La histopatología de la PED serosa es consistente con el desprendimiento de la membrana basal del EPR, junto con el EPR suprayacente de la membrana de Bruch restante debido a la acumulación de líquido(1).
La presencia de esta lesión es un factor pronóstico negativo para la DMAE en términos de resultado de agudeza visual.
Aunque hasta ahora no se han establecido indicaciones terapéuticas definitivas, la detección precoz de la DPE serosa es importante para el pronóstico y el tratamiento de los pacientes con DMAE.
En la DMAE, la DPE serosa puede estar asociada o no a nuevos vasos coroideos (neovascularización coroidea – NVC). Sin embargo, el tipo vascularizado es, con mucho, el más observado.
Se han propuesto varias teorías sobre la relación entre la PED serosa y la NVC.
Para explicar su patogénesis, Gass teorizó el crecimiento de nuevos vasos desde la coroides (neovascularización tipo 1 (NV)) dentro del espesor de la membrana de Bruch, que se filtran activamente, aumentando la presión hidrostática y provocando el desprendimiento del EPR entre las capas menos adherentes(2).
Este concepto ha sido posteriormente apoyado por la evidencia de que el desarrollo de la NVC viene acompañado de mecanismos inflamatorios que añaden más daño a la membrana de Bruch, apoyando la separación del EPR de la capa colágena interna(3-5).
Cuando se inicia el crecimiento de nuevos vasos desde la retina interna, más recientemente descrito como NV de tipo 3 y también conocido como proliferación angiomatosa retiniana (RAP), se ha hipotetizado que la formación de PED serosa, que se asocia con mucha frecuencia, puede estar relacionada con la invasión del EPR por el complejo neovascular6-8).
Por el contrario, otros autores observaron que la presencia de PED puede representar una condición preexistente que puede promover el crecimiento de la NVC a través de un mayor daño de la membrana de Bruch, expresión de la misma enfermedad en curso(9,10).
Aunque la patogénesis de la DEP no se entiende completamente, a partir de estos estudios la formación de la NV parece ser un momento crucial.
En el examen del fondo de ojo, la DEP serosa aparece como un área redonda u ovalada, con forma de cúpula distinta, de desprendimiento regular del EPR y de la retina neurosensorial suprayacente, con color amarillo a naranja y superficie lisa. Los márgenes suelen estar bien delimitados; y es frecuente observar atrofia focal del EPR y figuras pigmentarias(9,11).
Sin embargo, la presencia concomitante de NV puede generar una variedad de aspectos oftalmoscópicos asociados, como componentes hemorrágicos y exudativos, áreas de elevación irregular del EPR y desprendimiento seroso de la neurorretina circundante.
La presentación de la NV de tipo 1 localizada en el margen de la PED puede variar, dando lugar normalmente a un aspecto reniforme o con muescas, o a un desprendimiento del EPR de lado plano(12).
La PED serosa puede visualizarse mediante angiografía con fluoresceína (AF), angiografía con verde de indocianina (ICGA) y tomografía de coherencia óptica (OCT).
La AF representa, sin embargo, el patrón de oro para el diagnóstico de la PED serosa.
Examinada mediante AF, la PED serosa muestra clásicamente una hiperfluorescencia uniforme temprana de toda la lesión, ligeramente retrasada en comparación con la fluorescencia de fondo, que aumenta progresivamente de brillo a medida que avanza el examen (pooling).
La hiperfluorescencia de la PED serosa no suele cambiar de tamaño ni de forma durante las fases angiográficas.
El AF puede demostrar también la presencia de NV, generalmente asociada a la PED serosa como NV de tipo 1, como áreas de tinción subretiniana tardía indistinta, más evidente cuando se localiza en el margen del desprendimiento del EPR o correspondiente a la «muesca»(11).
La presencia de NV puede deducirse también por la presencia de un componente hemorrágico del PED, el menisco oscuro descrito por Gass(12).
Sin embargo, una localización más precisa del componente neovascular puede obtenerse con ICGA digital. La molécula de verde de indocianina tiene propiedades biofísicas que, a diferencia de la fluoresceína, la hacen útil para resaltar la anatomía de los vasos a través del EPR, la sangre y la exudación turbia.
En detalle, la ICGA permite delinear mejor la presencia y el tipo de nuevos vasos asociados a una PED serosa, por lo que se considera una herramienta fundamental en el manejo de esta enfermedad(13-15).
En la ICGA, la PED serosa aparece como una lesión hipofluorescente, con márgenes bien delimitados, que permanece constantemente hipofluorescente durante todas las fases del examen(16).
Cuando los nuevos vasos no están presentes, no se detectan signos de áreas hiperfluorescentes localizadas; el contorno de la PED es nítidamente redondo y por tanto se considera una PED serosa pura.
En pacientes con DMAE, Yannuzzi encontró una incidencia del 4% de PED no vascularizada entre las PED serosas(15).
Cuando el componente neovascular está presente, se ha sugerido el término PED vascularizada(15),.que representa aproximadamente el 24% de la DMAE exudativa de nuevo diagnóstico(17).
Los nuevos vasos asociados a la DPE serosa están representados en diferentes subtipos.
La videoangiografía de alta velocidad con oftalmoscopio láser de barrido aparece como una herramienta preciosa que permite al oftalmólogo identificar el patrón de los nuevos vasos y su comportamiento angiográfico(18).
Reconocer los diferentes tipos de NV, distinguiendo los hallazgos angiográficos, es obligatorio para el distinto curso natural, pronóstico visual y diferente respuesta al tratamiento de los tres principales tipos de nuevos vasos asociados a la DPE serosa en la DMAE.
El tipo más común de nuevos vasos asociados a la PED serosa son los que se producen desde la coroides por debajo de la monocapa del EPR(15-,17).
Estos nuevos vasos se han clasificado recientemente como NV de tipo 1 y son, con mucho, el tipo más común de NV en la DMAE(19)(Figura 1).

Figura 1 – PED vascularizada con NV de tipo 1. (A) FA, (B)ICGA y (C) OCT.
En las fases tempranas, la ICGA muestra la arteria alimentadora de la NV que surge de la circulación coroidea, y posteriormente la vénula drenante.
Al mismo tiempo se puede detectar la red capilar de la membrana neovascular.
A diferencia de la fluoresceína, el verde de indocianina se filtra ligeramente y la hiperfluorescencia del NV suele ser mínima, a excepción de algunos casos que muestran una fuga intensa, considerados como vasos nuevos muy activos.
Frecuentemente, en las fases tardías, puede apreciarse un área bien definida de hiperfluorescencia leve correspondiente a la red de NV.
El segundo tipo de vasos nuevos que complican la PED serosa son los RAP(7,20-22), también denominados NV tipo 3(19).
Estas lesiones vasculares, según han informado diversos autores, pueden implicar a la retina externa y al EPR, a través de una progresión que se ha hipotetizado que se origina en la circulación retiniana y/o en la coroides.
La ICGA muestra típicamente la presencia de un «punto caliente», debido a la hiperfluorescencia temprana del complejo neovascular intrarretiniano, que aumenta durante la angiografía, con una intensa fuga en las fases tardías.
Su brillo se ve potenciado por la hipofluorescencia circundante del CEP subyacente (Figura 2).
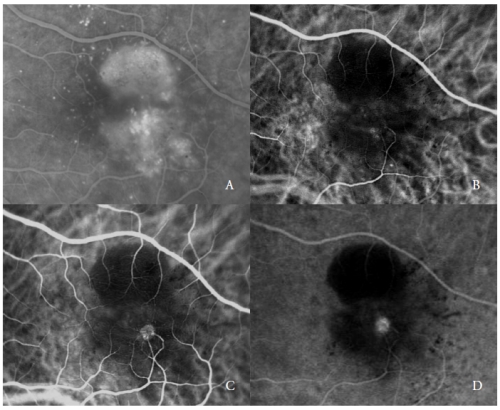
Figura 2 – CEP vascularizado con NV tipo 3 (RAP). FA (A) e ICGA fases tempranas (B) y tardías (C y D).
En las fases tardías de la enfermedad, el complejo neovascular coroideo suele estar conectado con uno o más vasos retinianos que aparecen tortuosos y dilatados(7,22,23).
La NV de tipo 3 puede ser única o múltiple, su origen es típicamente extrafoveal, y con frecuencia se observa una hemorragia intrarretiniana en correspondencia con la lesión neovascular(20).
El tercer tipo de vasos nuevos asociados a la PED serosa en la DMAE es consistente con la vasculopatía coroidea polipoidea (VCP)(24).
La PCV es una forma peculiar de NVC, caracterizada por la presencia de dilataciones redondas aneurismáticas, anaranjadas y con aspecto de pólipo en el borde de una red vascular ramificada de origen coroideo.
Aunque la NVC afecta con mayor frecuencia a la población negra y asiática de mediana edad, su espectro clínico se amplía a la población blanca, donde se ha comprobado su presencia en el 8-13% de los pacientes con lesiones concomitantes de DMAE.
En estos casos, cuando las manifestaciones atribuibles tanto a la NVC como a la DMAE están presentes, algunos autores consideran la NVC como un subtipo de NVC en la DMAE(24,25).
La manifestación hemorrágica es frecuente en los pacientes con VCP.
La PED serosa asociada a la VCP muestra con frecuencia un nivel sanguíneo en la porción inferior del desprendimiento.
La AGI es el examen más avanzado para distinguir las características típicas de los dos componentes vasculares.
La red vascular se caracteriza por la presencia de una o más lesiones aneurismáticas que muestran una fluorescencia brillante desde las fases tempranas, seguida en las fases tardías por un aclaramiento del colorante, llamado «wash-out», típico de esta enfermedad (Figura 3).
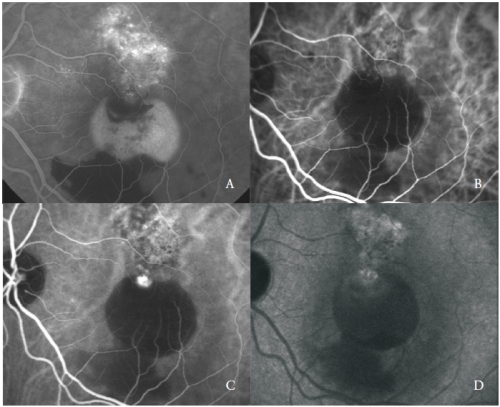
Figura 3 – PED vascularizada con PCV: FA (A) y fases tempranas (B), medias (C) y tardías (D) de ICGA.
Sin embargo, algunas estructuras de tipo pólipo pueden filtrarse activamente mostrando tinción tardía de sus paredes y exudación circundante.
Las lesiones polipoidales suelen localizarse en el margen de la DPE serosa(26).
El reconocimiento de estas lesiones es fundamental debido a su diferente evolución clínica, pronóstico y respuesta al tratamiento en comparación con los otros subtipos de DMAE neovascular.
La OCT proporciona imágenes que permiten una correlación exacta con los hallazgos angiográficos.
En las exploraciones transversales de la OCT, la DPE serosa aparece como una elevación en forma de cúpula ópticamente vacía de la banda externa de alta reflexión -el EPR, que se desprende de forma pronunciada de la membrana de Bruch(26).
La retina suprayacente, normalmente adherida a la PED bullosa, en los márgenes de la lesión, puede estar ligeramente desprendida del EPR subyacente.
La OCT puede proporcionar más información adicional en la PED vascularizada(28).
Los cortes tomográficos, guiados por FA e ICGA en la zona correspondiente a la NVC, muestran una elevación más suave del EPR, continua con el desprendimiento seroso, con una retrodispersión más profunda, debido a la presencia del tejido fibrovascular.
Las áreas hiporreflectantes de espacios ópticamente vacíos homogéneos, referibles a la acumulación de líquido, están frecuentemente presentes en los espacios intrarretinianos y subretinianos(29).
Los espacios ópticamente vacíos intrarretinianos son más pronunciados cuando el DEP seroso se asocia a una NV de tipo 3, especialmente con forma quística (Figura 4).
Posicionando la línea de exploración correspondiente al «punto caliente», la anomalía neovascular se representa como una zona preepitelial densa o hiperreflectante en las capas internas de la retina, donde las capas hiperreflectantes externas ya no son detectables(30).
El EPR cercano a esa lesión muestra con frecuencia efracciones o interrupciones en su capa hiperreflectante(31).
La medición topográfica de la retina sostiene un aumento del grosor retiniano.
En los ojos con PED serosa y PCV, las lesiones polipoidales muestran una protrusión aguda del EPR, similar a la del PED pero con una pendiente pronunciada.
La cavidad de los pólipos, generalmente vacía ópticamente, es contigua a la elevación irregular del EPR, expresión del componente neovascular oculto de la lesión(32,33).
El líquido subretiniano e intrarretiniano, observado como áreas ópticamente vacías hipofluorescentes, se relaciona con la actividad del PCV (Figura 4-B).
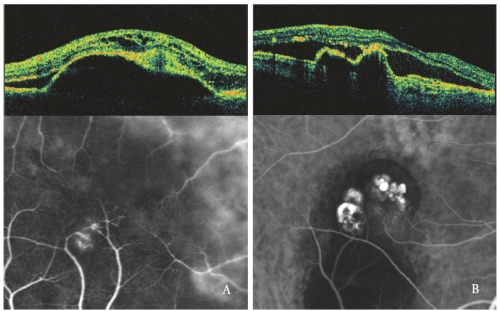
Figura 4 – NV de tipo 3 (RAP) (izquierda) y PCV (derecha): Patrones OCT e ICGA.
La reciente introducción de la angiografía OCT (OCT-A) ha permitido obtener imágenes de la perfusión de las diferentes capas retinianas, sin inyección del colorante y utilizando el flujo endoluminal como contraste intrínseco.
La figura 5 ofrece un ejemplo de cómo la OCT-A visualiza la red coroidea en un caso de PCV.
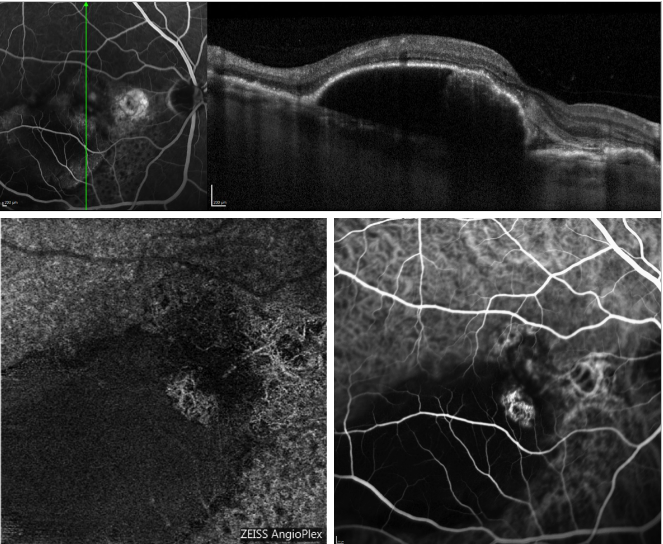
Figura 5 – PED serosa y PCV recurrente (FA, OCT, ICGA y OCT-A). En la parte superior, exploración OCT adquirida simultáneamente con FA; En la parte inferior, aspecto del perfil de los pólipos en OCT-A (izquierda) e ICGA (derecha).
Sin embargo, la naturaleza estática de este examen y la presencia de posibles artefactos son limitaciones importantes que deben reconocerse.
En el caso de la DEP serosa, la sombra debida a la pérdida de transmisión de la señal en correspondencia con la DEP puede dificultar la detección del complejo de NVC en la OCT-A (Figura 6).
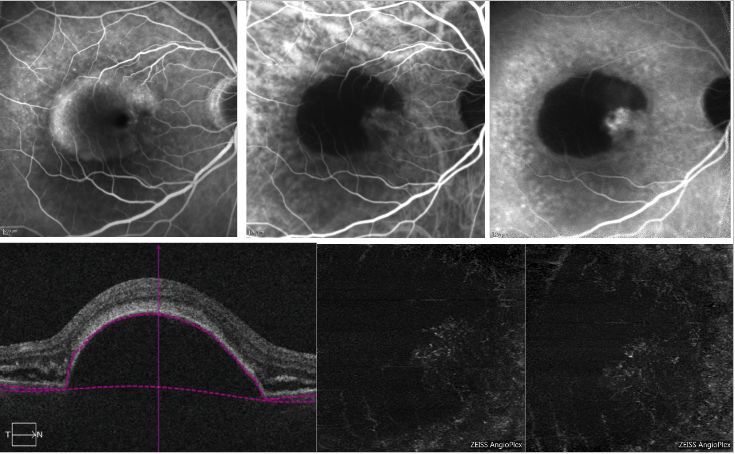
Figura 6 – DEP vascularizada y DEP serosa con NV de tipo 1 (FA, ICGA y OCT-A) . En la parte superior, la FA (izquierda) muestra la acumulación de colorante debido a la presencia de una PED serosa; la ICGA (parte superior central y derecha) muestra una red neovascular en el borde de la PED (muesca); en la parte inferior, la OCT-A no proporciona una imagen definida de la red neovascular.
El curso natural de la PED serosa depende de la presencia o no del componente neovascular(34).
En la PED serosa pura suele haber un lento agrandamiento de la lesión, con una mínima progresión de la pérdida visual durante un largo periodo (meses o años).
Sin embargo, muchas pueden desarrollar posteriormente neovascularización, que la agrava(35).
El curso natural en la PED vascularizada puede variar, y está relacionado con el tipo de nuevos vasos asociados.
La complicación aguda más común de la PED es el desgarro del EPR(36-39).
Suele producirse en el borde de la PED, en la intersección del EPR desprendido y el adherido.
Clinicamente, el desgarro o rasgadura del EPR aparece como una zona bien definida de coroides desnuda, contigua a una zona rugosa hiperpigmentada más oscura, que corresponde al montículo del EPR desprendido(40,41).
El EPR desgarrado suele rodar hacia la NVC, y su propensión al desgarro puede predecirse por la observación de las características previas al desgarro, como el aumento del tamaño y la modificación de la forma, la presencia de pequeños agujeros en los márgenes del EPR, la presencia de hemorragias o líquido subretiniano, pero los aspectos más destacables son el relleno irregular del PED visible en la AF, altura del PED > 580 nm, duración > 4.5 meses, líneas radiales hiperreflectantes en las imágenes de reflectancia cercana, menor proporción de PED vascularizado y tratamiento con factor de crecimiento endotelial antivascular (anti-VEGF)(42-46).
Los desgarros del PED se producen de forma espontánea o después de un tratamiento, formalmente fotocoagulación con láser, terapia fotodinámica e inyección intravítrea de esteroides o agentes anti-VEGF(47- 58).
La patogénesis exacta de los desgarros del EPR es poco conocida.
En cuanto al curso natural de los EPI, se ha planteado la hipótesis de que las fuerzas de cizallamiento tangencial en el EPI pueden causar la rotura de la membrana basal del EPR en el borde del desprendimiento; sin embargo, es más probable que sea el resultado de varias variables, donde la presencia de una NVC juega un papel importante.
Se han descrito varias relaciones causales para los desgarros del EPR que se producen después del tratamiento, incluyendo el calor generado por la fotocoagulación, el aumento brusco del líquido intra-PED, una contracción de la NVC asociada y la resolución repentina concomitante del líquido sub-PED.
También se han descrito como agentes causales la presencia combinada de tracción vitreomacular y la deformación del globo terráqueo debido al traumatismo mecánico por la aguja(59).
Después de los desgarros del EPR, la mayoría de los pacientes se quejan de una grave y repentina disminución visual.
En un pequeño porcentaje de ojos, en los que el desgarro salva la fóvea, los pacientes pueden experimentar una conservación temporal de una buena función visual(60).
Sin embargo, a largo plazo, la progresión de una cicatriz subretiniana conduce a una grave disminución visual. En el pronóstico de la PED serosa debe considerarse también el alto riesgo de afectación bilateral(61).
El tratamiento de la PED serosa, asociada o no a NVC, ha sido siempre un reto y hasta el momento no existen guías recomendadas para su manejo.
Las PED serosas puras han sido tratadas en el pasado con fotocoagulación láser en cuadrícula o dispersa, sin embargo con resultados decepcionantes(61).
El tratamiento de las PED serosas, asociadas o no a la NVC, siempre ha sido un reto y hasta ahora no hay directrices recomendadas para su manejo. Las PED serosas puras han sido tratadas en el pasado con fotocoagulación láser en cuadrícula o dispersa, con resultados decepcionantes(62).
No se han intentado otros enfoques para tratar estas lesiones.
Cuando hay una red neovascular, el tratamiento de las PED serosas se ha centrado en el manejo de la NVC. Sin embargo, dado que las PED vascularizadas nunca se han incluido en los principales ensayos controlados aleatorizados, tenemos que tomar la decisión de tratamiento basándonos en las pequeñas series publicadas, que a menudo son retrospectivas e implican diferentes enfoques terapéuticos.
Ahora, en la era de la terapia anti-VEGF, todos los tratamientos empleados anteriormente parecen insatisfactorios.
La fotocoagulación con láser ha sido ampliamente empleada y podría tener todavía una indicación limitada cuando una NVC bien definida por ICGA se encuentra alejada del EPR desprendido(63).
Se ha demostrado que la terapia fotodinámica (TFD) con verteporfina sola es perjudicial, aumentando el riesgo de desgarro del EPR, hemorragias y disminución repentina de la agudeza visual(39,48,49,64) (Figura 7).
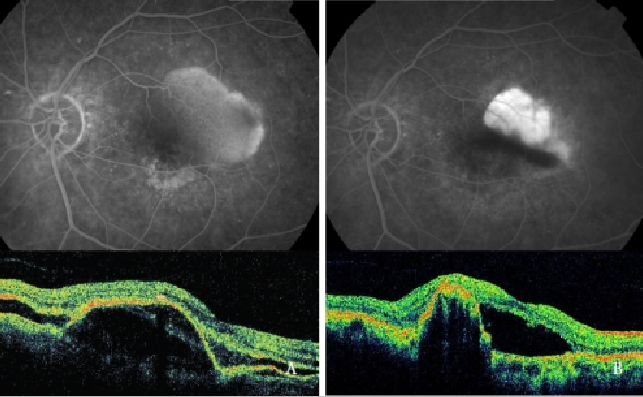
Figura 7 – PED vascularizada con NVC (NV tipo 1) antes (izquierda) y después (derecha) de la TFD: Desgarro del EPR (FA y OCT).
Sin embargo, la TFD combinada con la inyección intravítrea de acetónido de triamcinolona (IVTA) ha demostrado ser potencialmente capaz de estabilizar la agudeza visual y reducir las recurrencias(65).
No obstante, la alta tasa de complicaciones (catarata y glaucoma) ha reducido el uso de la triamcinolona intravítrea.
Después de los alentadores resultados obtenidos con la terapia intravítrea anti-VEGF en el tratamiento de la NVC oculta, el uso del tratamiento anti-VEGF se ha extendido a la PED vascularizada con resultados decepcionantes(66-69).
Tanto las complicaciones agudas como la mala respuesta anatómica al tratamiento invalidan con frecuencia nuestros intentos de curar la lesión. Se ha informado de que los desgarros del EPR y las hemorragias subretinianas complican los tratamientos intravítreos con ranibizumab y bevacizumab(51-57).
Además, el líquido sub EPR apenas responde a la terapia anti-VEGF, posiblemente debido a los cambios de hidroconductividad de la membrana de Bruch(69).
En una serie de casos retrospectiva de 328 pacientes tratados con bevacizumab, ranibizumab, pegaptanib y PDT+IVTA respectivamente, tras un seguimiento medio de 42,4 semanas, los autores informaron de una estabilización significativa de la agudeza visual en cada grupo, mejor en los de bevacizumab y ranibizumab en comparación con los otros dos, y una frecuencia global de desgarros del EPR del 12.Sin embargo, concluyen que con estos tratamientos sólo se puede obtener una regresión parcial de las lesiones y no se evita el riesgo de desgarros del EPR(69).
Otro estudio retrospectivo(58) revisó los resultados de los pacientes de PED vascularizados tratados con TFD sola, TFD combinada con IVTA o inyecciones intravítreas de anti-VEGF sola (bevacizumab o ranibizumab) y mostró mejores resultados funcionales para el grupo de tratamiento con anti-VEGF.
Además, en esta serie, la NV de tipo 1 con PED vascularizada en comparación con la NV de tipo 3, junto con una mejor agudeza visual al inicio, mostró un mayor riesgo de desgarro agudo del EPR tras el tratamiento(58).
En un reciente estudio prospectivo(19), el tratamiento de la PED asociada a la NV de tipo 1 subfoveal con inyección intravítrea de ranibizumab y con una fase de carga de 3 meses y una estrategia pro re nata condujo a resultados sólo parciales durante un seguimiento de 24 meses.
Recientemente varios estudios han investigado la eficacia del tratamiento con aflibercept intravítreo de la DPE en la DMAE mostrando una buena respuesta anatómica con mejora o sin cambios significativos en la agudeza visual(70-73).
Además, aflibercept intravítreo ha demostrado ser un tratamiento prometedor en la DPE resistente al tratamiento con ranibizumab intravítreo(72-74).Varios estudios han identificado factores que podrían influir en la respuesta de la DEP al tratamiento con anti-VEGF(75-78).
Dirani et al.(75) demostraron que una mejoría visual se asociaba a una menor agudeza visual inicial, a la presencia de líquido subretiniano y a la RAP. Además, en su serie, la reducción de la DPE se asoció con una mayor DPE al inicio, una DPE predominantemente serosa y el uso de aflibercept.
Cho et al.(76), en una serie de casos reciente, encontraron que una menor altura de la DPE al inicio, PCV o RAP en comparación con la DMAE neovascular típica, una DPE serosa en comparación con una DPE fibrovascular y aflibercept en comparación con ranibizumab, tienen una mayor probabilidad de resolución de la DPE durante el tratamiento anti-VEGF de la DPE.
Sin embargo, en un reciente análisis post hoc de un ensayo controlado aleatorio de fase III(77), se ha demostrado que, a los 24 meses del inicio del tratamiento anti-VEGF, alrededor de la mitad de los pacientes que presentaban DPE al inicio mostraron una resolución completa de la DPE, independientemente del estado de la DPE y de la altura al inicio.
Recientemente, Chen et al.(78) destacaron la importancia de diferenciar los ojos que presentan RAP, ya que tienen mejores resultados anatómicos y funcionales con menos inyecciones en comparación con la PED con NV tipo 1.
En el futuro, las nuevas terapias combinadas y las nuevas estrategias terapéuticas, junto con la identificación de nuevos biomarcadores clínicos de respuesta al tratamiento, ayudarán a mejorar el pronóstico de los pacientes afectados por PED vascularizada.