 La Tautomerización de Ceto Enol o KET, es una reacción de química orgánica en la que las moléculas de cetona y enol pueden isomerizarse o interconvertirse, normalmente en una reacción catalizada por ácido o base.
La Tautomerización de Ceto Enol o KET, es una reacción de química orgánica en la que las moléculas de cetona y enol pueden isomerizarse o interconvertirse, normalmente en una reacción catalizada por ácido o base.
La Tautomerización Ceto Enol aparecerá bastantes veces en su curso de química orgánica, empezando por las reacciones de hidratación de alquinos, y apareciendo de nuevo en sus reacciones avanzadas (orgo 2) de enolado y condensación.
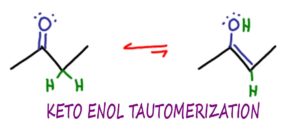
La Tautomerización es un tipo muy específico de isomerización,
en este caso la interconversión entre las formas ceto y enol de una molécula.

Keto se refiere al grupo funcional cetona – aunque KET no se limita a las cetonas JUST.
Los aldehídos, que son muy similares a las cetonas,
excepto por un hidrógeno terminal,
también pueden sufrir tautomerización.
 Enol viene de ‘Ene’ como en alqueno,
Enol viene de ‘Ene’ como en alqueno,
un doble enlace carbono-carbono.
Y ‘ol’ como en alcohol – un grupo OH.
¿Se siente oxidado? Repasa los grupos funcionales de la química orgánica
Si la tautomerización es como la isomerización,
Piensa en los tautómeros como en los isómeros, específicamente en los isómeros constitucionales.
El término Tautómeros se refiere a las dos formas específicas de la molécula que pueden interconvertirse en el equilibrio.
En el KET, las formas Keto y Enol son tautómeros el uno del otro.

¿Cuál es más estable, Keto o Enol?
A pesar de ser una reacción reversible, la forma keto es más estable y por lo tanto favorecida por el equilibrio.
Esto se debe a que el carbono doble unido al oxígeno es más estable que un carbono simple unido al oxígeno y simple unido al hidrógeno.
Afortunadamente, esta matemática es de la termodinámica cubierta de nuevo en la química general y algo que no tienes que calcular en el nivel de química orgánica (aunque algunos profesores todavía lo requieren).
Esto no es una regla dura y rápida.
Hay algunas situaciones en las que la forma enol proporcionará una mayor estabilidad a la molécula en general. Echa un vistazo al siguiente ejemplo:

La forma ceto tiene un carbonilo más estable, pero la forma enol permite que el enlace pi forme parte de un sistema aromático mucho más estable (revisa la aromaticidad aquí). Por lo tanto, la forma enol de esta molécula predominará en el equilibrio.
La tautomerización ceto enol surgirá en varias reacciones orgánicas, empezando por la hidroboración y la oximerización de alquinos.
KET en la oximerización de alquinos
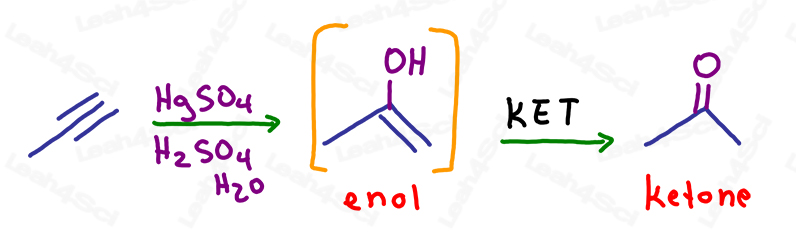
Al igual que con los alquenos, la reacción de oximerización simplemente rompe UN enlace pi para añadir un alcohol al carbono más sustituido, siguiendo la regla de Markovnikov.
La molécula resultante sigue teniendo un enlace pi: un alqueno en el mismo carbono que el alcohol.
Se trata de un enol inestable y sufrirá automáticamente la tautomerización del cetoenol para formar un producto final más estable, la cetona.
KET en la hidroboración de alquinos
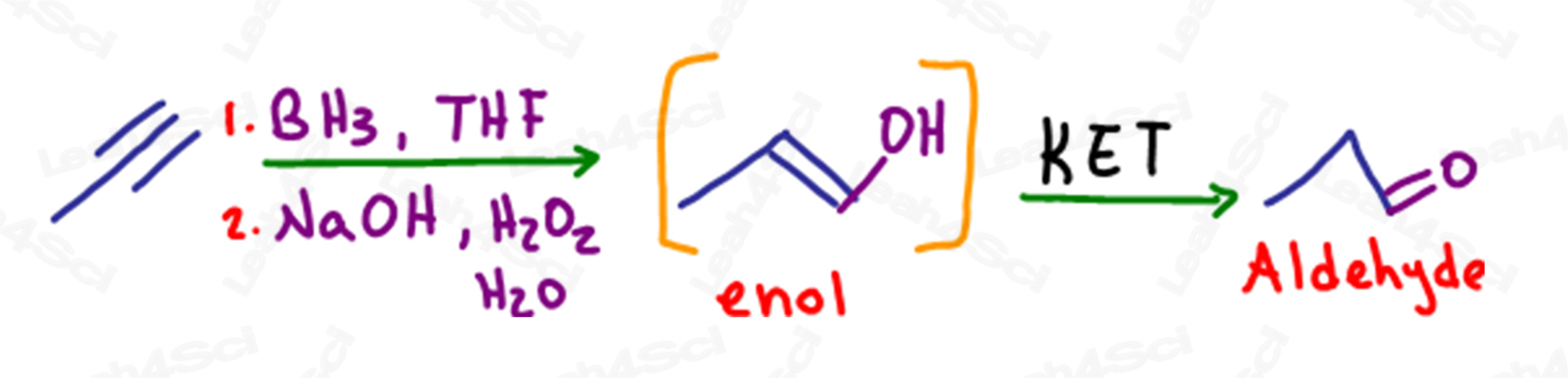
Al igual que con los alquenos, la hidroboración es una reacción anti-Markovnikov en la que se rompe un enlace pi y se añade un alcohol al carbono menos sustituido.
En el caso de un alquino terminal, cuando un único enlace pi se convierte en un alcohol, el carbono terminal sigue teniendo un enlace pi o alqueno, lo que lo convierte en un enol.
Esta molécula también sufrirá una tautomerización para formar un producto aldehído más estable.
A pesar de formar un aldehído, esta reacción se sigue considerando tautomerización de ceto enol.
Para estas 2 reacciones, la cetona o el aldehído resultante se determina por la ubicación del enol.
Si el enol está en un carbono interno (no terminal), el producto resultante formará una cetona.
Si el enol es terminal, entonces el carbonilo resultante será un aldehído.
La tautomerización puede ocurrir tanto en condiciones catalizadas por ácidos como por bases.
Con las reacciones anteriores, considere cuáles tienen que ser las condiciones después de someterse a la hidratación como se ha escrito.
El vídeo de abajo te guía paso a paso
- Reacción de tautomerización catalizada por ácido y mecanismo
- Reacción de tautomerización catalizada por base y mecanismo
- La reacción inversa (forma ceto a enol) para ambas reacciones
Mecanismo de tautomerización catalizada por ácido-.Catalyzed Tautomerization Mechanism Overview
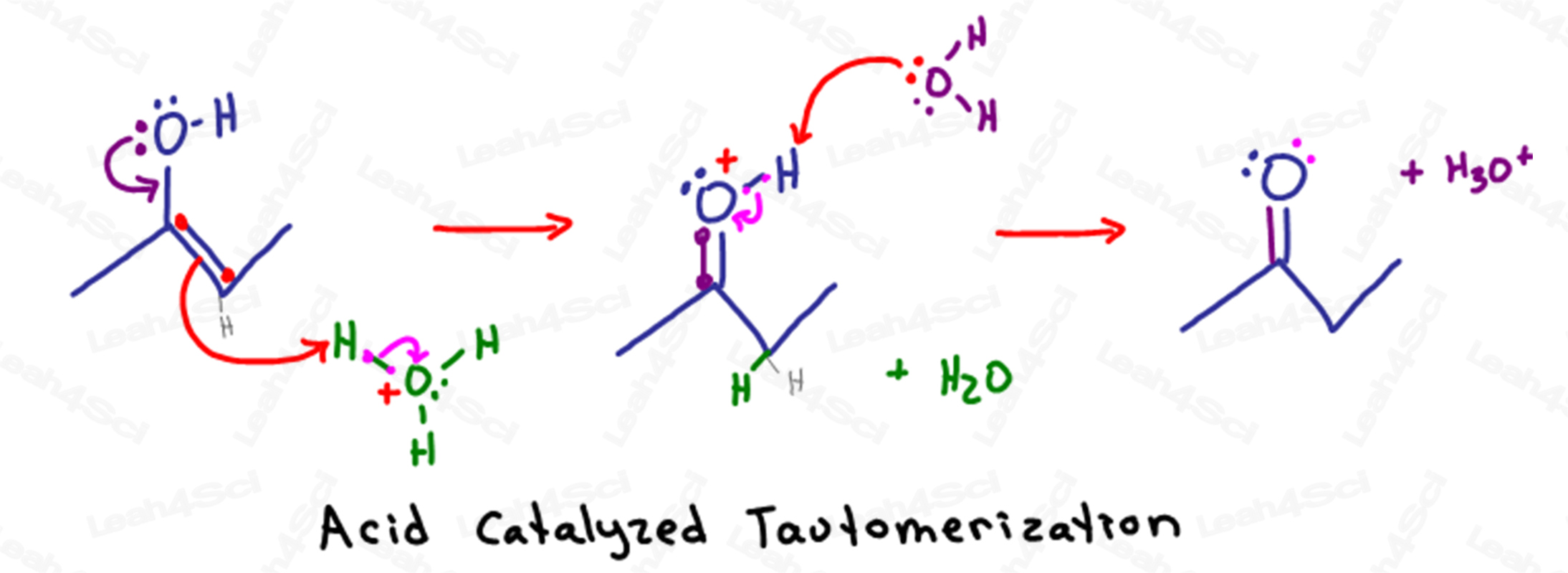
Recuerda que en las soluciones acuosas ácidas tenemos mucha agua e hidronio (H3O+) disponible en la solución.
La tautomerización comienza cuando los electrones parcialmente negativos del oxígeno del alcohol llegan hasta atacar el átomo de carbono sp2 (el que mantiene el enlace pi).
Al formar un segundo enlace entre el carbono y el oxígeno, el carbono tendría un total de 5 enlaces.
Para evitar violar su octeto, el carbono expulsará el enlace pi entre él y el otro átomo de carbono sp2 empujando los electrones hacia el otro carbono.
En lugar de sentarse como un par solitario en el carbono, los electrones negativos son atraídos por el átomo H+ parcialmente positivo en una molécula de hidronio cercana.
Como ese átomo de H+ sólo puede tener un enlace, suelta los electrones que lo mantienen unido al oxígeno, permitiendo que el agua se aleje en la solución.
La molécula resultante se parece a una cetona, excepto por el inestable átomo de oxígeno.
El oxígeno, con 2 enlaces al carbono, 1 enlace al hidrógeno y un único par solitario, tiene una carga positiva inestable.
Otra molécula de agua en disolución utiliza sus electrones parcialmente negativos para desprotonar el oxígeno devolviendo así sus electrones para formar una cetona estable neutra.
Hagamos un poco de contabilidad rápida.
Esta reacción comenzó cuando el enol atacó al hidronio, nuestro catalizador ácido.
En el último paso, el agua desprotoniza la cetona, reformando nuestro catalizador ácido de hidronio.
Recordatorio: si el enol es terminal el producto resultante es un aldehído en lugar de una cetona
Resumen del mecanismo de tautomerización catalizada por bases
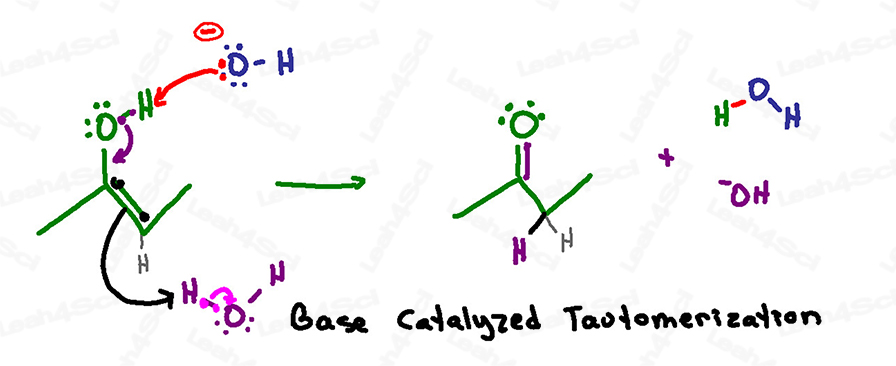
Recordatorio: en una solución acuosa básica tenemos tanto hidróxido como agua flotando.
¡Nunca muestres H+ o hidronio en una solución básica!
Esta reacción es muy similar al mecanismo catalizado por el ácido, excepto que la desprotonación es el primer paso en lugar del último.
Esto se debe a que la solución básica puede manejar un oxígeno negativo, pero la solución ácida no permite que se forme un oxígeno negativo.
Esta reacción comienza cuando un hidróxido básico en solución alcanza el hidrógeno ácido en el enol.
En lugar de colapsar de nuevo sobre el oxígeno para formar un óxido negativo, los electrones colapsan rápidamente hacia abajo para formar un enlace pi de carbonilo entre el carbono y el oxígeno.
Al igual que con el mecanismo catalizado por el ácido, el carbono debe expulsar su doble enlace actual para evitar tener 5 enlaces y violar su octeto.
Los electrones del enlace pi no se sientan y esperan en el otro carbono, en su lugar, buscan y toman un protón de la solución – tomándolo de una molécula de agua.
En una sola serie de ataques (un paso), tenemos una cetona como nuestro producto final.
Atención a lo que se utilizó y reformó en esta reacción:
El hidróxido agarró un protón formando agua,
Pero el enol agarró un protón del agua formando hidróxido y reformando así el catalizador básico que inició esta reacción.
Recordatorio: si el enol es terminal el producto resultante es un aldehído en lugar de una cetona