Se pueden formar enlaces de hidrógeno entre el par solitario del átomo de nitrógeno muy electronegativo y el átomo de hidrógeno ligeramente positivo de otra molécula.
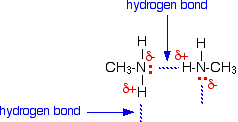
El enlace de hidrógeno no es tan eficiente como lo es, por ejemplo, en el agua, porque hay una escasez de pares solitarios. Algunos átomos de hidrógeno ligeramente positivos no podrán encontrar un par solitario con el que establecer un enlace de hidrógeno. Hay el doble de hidrógenos adecuados que de pares solitarios.
Los puntos de ebullición de las aminas primarias aumentan a medida que se incrementa la longitud de la cadena debido a la mayor cantidad de fuerzas de dispersión de Van der Waals entre las moléculas más grandes.
Las aminas secundarias
Para una comparación justa habría que comparar el punto de ebullición de la dimetilamina con el de la etilamina. Son isómeros el uno del otro – cada uno contiene exactamente el mismo número de átomos iguales.
El punto de ebullición de la amina secundaria es un poco más bajo que el de la amina primaria correspondiente con el mismo número de átomos de carbono.
Las aminas secundarias siguen formando enlaces de hidrógeno, pero el hecho de tener el átomo de nitrógeno en el centro de la cadena en lugar de en el extremo hace que el dipolo permanente en la molécula sea ligeramente menor.
El punto de ebullición más bajo se debe a las menores atracciones dipolo-dipolo en la dimetilamina en comparación con la etilamina.
Aminas terciarias
Esta vez para hacer una comparación justa habría que comparar la trimetilamina con su isómero el 1-aminopropano.
Si vuelves a mirar la tabla más arriba, verás que la trimetilamina tiene un punto de ebullición mucho más bajo (3,5°C) que el 1-aminopropano (48,6°C).
En una amina terciaria no hay ningún átomo de hidrógeno unido directamente al nitrógeno. Esto significa que el enlace de hidrógeno entre las moléculas de amina terciaria es imposible. Por eso el punto de ebullición es mucho más bajo.
Solubilidad en agua
Las aminas pequeñas de todos los tipos son muy solubles en agua. De hecho, las que normalmente se encontrarían como gases a temperatura ambiente se venden normalmente como soluciones en agua – de la misma manera que el amoníaco se suele suministrar como solución de amoníaco.
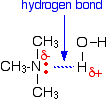
Todas las aminas pueden formar enlaces de hidrógeno con el agua – incluso las terciarias.
Aunque las aminas terciarias no tienen un átomo de hidrógeno unido al nitrógeno y por lo tanto no pueden formar enlaces de hidrógeno con ellas mismas, pueden formar enlaces de hidrógeno con las moléculas de agua simplemente utilizando el par solitario del nitrógeno.
La solubilidad disminuye a medida que las cadenas de hidrocarburos se hacen más largas – notablemente después de unos 6 carbonos. Las cadenas de hidrocarburos tienen que forzar su camino entre las moléculas de agua, rompiendo los enlaces de hidrógeno entre las moléculas de agua.
Sin embargo, no los sustituyen por nada tan fuerte, y por lo tanto el proceso de formación de una solución es cada vez menos factible energéticamente a medida que la longitud de la cadena crece.
Olor
Las aminas muy pequeñas, como la metilamina y la etilamina, huelen de forma muy similar al amoníaco -aunque si se comparan una al lado de la otra, los olores de las aminas son ligeramente más complejos.
A medida que las aminas se hacen más grandes, tienden a oler más «a pescado», o huelen a descomposición.
Si está familiarizado con el olor de la flor de espino (y con cosas de olor similar como la flor de cotoneaster), este es el olor de la trimetilamina – un olor dulce y bastante enfermizo como las primeras etapas de la carne en descomposición.
Preguntas para comprobar tu comprensión
Si esta es la primera serie de preguntas que haces, por favor lee la página de introducción antes de empezar. Tendrás que usar el BOTÓN ATRÁS de tu navegador para volver aquí después.
Preguntas sobre la introducción a las aminas
Respuestas
¿A dónde quieres ir ahora?
Al menú de aminas . .
Al menú de otros compuestos orgánicos . .
Al menú principal . .