Obiettivi di apprendimento
- Spiegare la funzione e i cambiamenti di colore degli indicatori acido-base
- Dimostrare come selezionare l’indicatore appropriato per un esperimento di titolazione
- Determinare le costanti di dissociazione acida Ka o Kai degli indicatori.
Alcune sostanze organiche cambiano colore in soluzione diluita quando la concentrazione di ioni idronio raggiunge un particolare valore. Per esempio, la fenolftaleina è una sostanza incolore in qualsiasi soluzione acquosa con una concentrazione di ioni idronio superiore a 5,0 × 10-9 M (pH < 8,3). In soluzioni più basiche dove la concentrazione di ioni idronio è inferiore a 5,0 × 10-9 M (pH > 8,3), è rosso o rosa. Sostanze come la fenolftaleina, che possono essere utilizzate per determinare il pH di una soluzione, sono chiamate indicatori acido-base. Gli indicatori acido-base sono o acidi organici deboli o basi organiche deboli.
L’equilibrio in una soluzione dell’indicatore acido-base arancio metile, un acido debole, può essere rappresentato da un’equazione in cui usiamo HIn come semplice rappresentazione della molecola complessa di arancio metile:
\
{}}}=4.0×10^{-4}]
L’anione dell’arancio metile, In-, è giallo, e la forma non ionizzata, HIn, è rossa. Quando aggiungiamo acido a una soluzione di arancio metile, l’aumento della concentrazione dello ione idronio sposta l’equilibrio verso la forma rossa non ionizzata, in accordo con il principio di Le Chatelier. Se aggiungiamo una base, spostiamo l’equilibrio verso la forma gialla. Questo comportamento è del tutto analogo all’azione dei tamponi.
Il colore di un indicatore è il risultato visibile del rapporto delle concentrazioni delle due specie In- e HIn. Se la maggior parte dell’indicatore (tipicamente circa il 60-90% o più) è presente come In-, allora vediamo il colore dello ione In-, che sarebbe giallo per l’arancio di metile. Se la maggior parte è presente come HIn, allora vediamo il colore della molecola di HIn: rosso per l’arancio di metile. Per l’arancione metilico, possiamo riorganizzare l’equazione per Ka e scrivere:
{}}=\dfrac{}{}==dfrac{mathit{K}_a}{}}]
Questo ci mostra come il rapporto di \(\ce{dfrac{}}}) varia con la concentrazione dello ione idronio. L’espressione precedente che descrive l’equilibrio dell’indicatore può essere riorganizzata:
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:o:pH=p\mathit{K}_a+log\left(\dfrac{}{}destra)}]
L’ultima formula è la stessa dell’equazione di Henderson-Hasselbalch, che può essere usata per descrivere l’equilibrio degli indicatori.
Quando ha lo stesso valore numerico di Ka, il rapporto di a è uguale a 1, il che significa che il 50% dell’indicatore è presente nella forma rossa (HIn) e il 50% è nella forma ionica gialla (In-), e la soluzione appare di colore arancione. Quando la concentrazione dello ione idronio aumenta a 8 × 10-4 M (un pH di 3,1), la soluzione diventa rossa. Nessun cambiamento di colore è visibile per qualsiasi ulteriore aumento della concentrazione di ioni idronio (diminuzione del pH). A una concentrazione di ioni idronio di 4 × 10-5 M (un pH di 4,4), la maggior parte dell’indicatore è nella forma ionica gialla, e un’ulteriore diminuzione della concentrazione di ioni idronio (aumento del pH) non produce un cambiamento di colore visibile. L’intervallo di pH tra 3,1 (rosso) e 4,4 (giallo) è l’intervallo di cambiamento di colore dell’arancia metilica; il cambiamento di colore pronunciato avviene tra questi valori di pH.
Molte sostanze diverse possono essere usate come indicatori, a seconda della particolare reazione da monitorare. Per esempio, il succo di cavolo rosso contiene una miscela di sostanze colorate che cambiano dal rosso intenso a basso pH al blu chiaro a pH intermedio al giallo ad alto pH (Figura \(\PageIndex{1}}). In tutti i casi, però, un buon indicatore deve avere le seguenti proprietà:
- Il cambiamento di colore deve essere facilmente rilevabile.
- Il cambiamento di colore deve essere rapido.
- La molecola dell’indicatore non deve reagire con la sostanza da titolare.
- Per minimizzare gli errori, l’indicatore dovrebbe avere un pKin che è entro un’unità di pH del pH previsto al punto di equivalenza della titolazione.

Il succo di cavolo rosso contiene una miscela di sostanze il cui colore dipende dal pH. Ogni provetta contiene una soluzione di succo di cavolo rosso in acqua, ma il pH delle soluzioni varia da pH = 2,0 (estrema sinistra) a pH = 11,0 (estrema destra). A pH = 7,0, la soluzione è blu.
Sono stati sviluppati indicatori sintetici che soddisfano questi criteri e coprono virtualmente l’intera gamma di pH. La figura \(\PageIndex{2}) mostra l’intervallo approssimativo di pH in cui alcuni indicatori comuni cambiano colore e il loro cambiamento di colore. Inoltre, alcuni indicatori (come il blu di timolo) sono acidi o basi poliprotici, che cambiano colore due volte a valori di pH ampiamente separati.
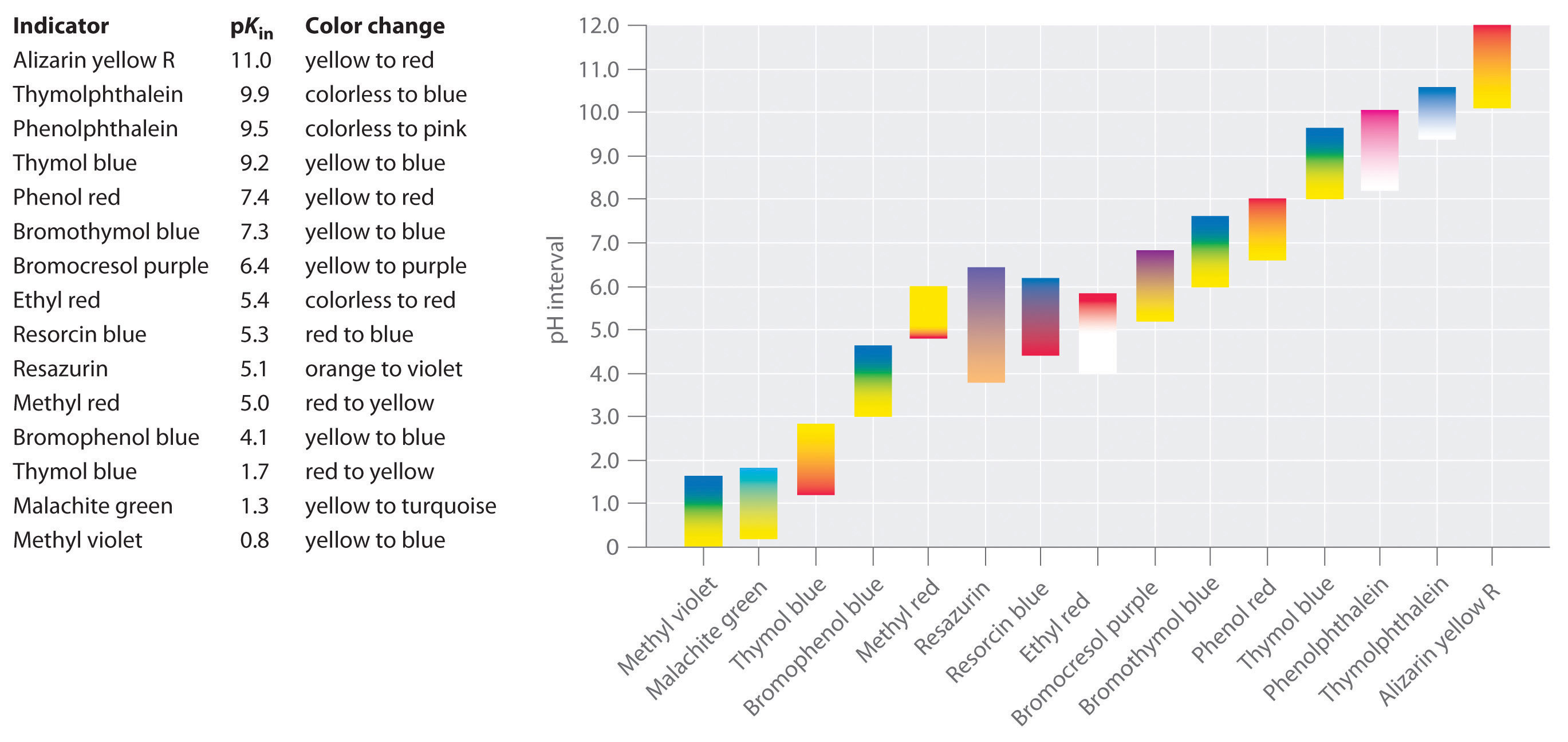
È importante essere consapevoli che un indicatore non cambia bruscamente colore ad un particolare valore di pH; invece, subisce effettivamente una titolazione del pH proprio come qualsiasi altro acido o base. Come la concentrazione di HIn diminuisce e la concentrazione di In- aumenta, il colore della soluzione cambia lentamente dal colore caratteristico di HIn a quello di In-. Come vedremo nella sezione 16, il rapporto / cambia da 0,1 a un pH un’unità sotto il pKin a 10 a un pH un’unità sopra il pKin. Quindi la maggior parte degli indicatori cambia colore in un intervallo di pH di circa due unità di pH.
Abbiamo affermato che un buon indicatore dovrebbe avere un valore di pKin che è vicino al pH previsto al punto di equivalenza. Per una titolazione acido forte-base forte, la scelta dell’indicatore non è particolarmente critica a causa del cambiamento molto grande di pH che avviene intorno al punto di equivalenza. Al contrario, usare l’indicatore sbagliato per una titolazione di un acido debole o di una base debole può portare a errori relativamente grandi, come illustrato nella figura \(\PageIndex{3}). Questa figura mostra i grafici del pH rispetto al volume di base aggiunta per la titolazione di 50,0 mL di una soluzione 0,100 M di un acido forte (HCl) e un acido debole (acido acetico) con 0,100 M (NaOH). Le gamme di pH in cui due indicatori comuni (rosso metile, \(pK_{in} = 5.0\), e fenolftaleina, \(pK_{in} = 9.5\)) cambiano colore sono anche mostrati. Le barre orizzontali indicano gli intervalli di pH in cui entrambi gli indicatori cambiano colore attraversano la curva di titolazione HCl, dove è quasi verticale. Quindi entrambi gli indicatori cambiano colore quando è stato aggiunto essenzialmente lo stesso volume di \(NaOH\) (circa 50 mL), che corrisponde al punto di equivalenza. Al contrario, la titolazione dell’acido acetico darà risultati molto diversi a seconda che si usi come indicatore il rosso metile o la fenolftaleina. Anche se l’intervallo di pH in cui la fenolftaleina cambia colore è leggermente maggiore del pH al punto di equivalenza della titolazione dell’acido forte, l’errore sarà trascurabile a causa della pendenza di questa parte della curva di titolazione. Proprio come con la titolazione HCl, l’indicatore fenolftaleina diventerà rosa quando circa 50 mL di \(NaOH\) sono stati aggiunti alla soluzione di acido acetico. Al contrario, il rosso metile inizia a cambiare da rosso a giallo intorno a pH 5, che è vicino al punto medio della titolazione dell’acido acetico, non il punto di equivalenza. Aggiungendo solo circa 25-30 mL di \(NaOH\), l’indicatore rosso metile cambierà colore, con un conseguente enorme errore.
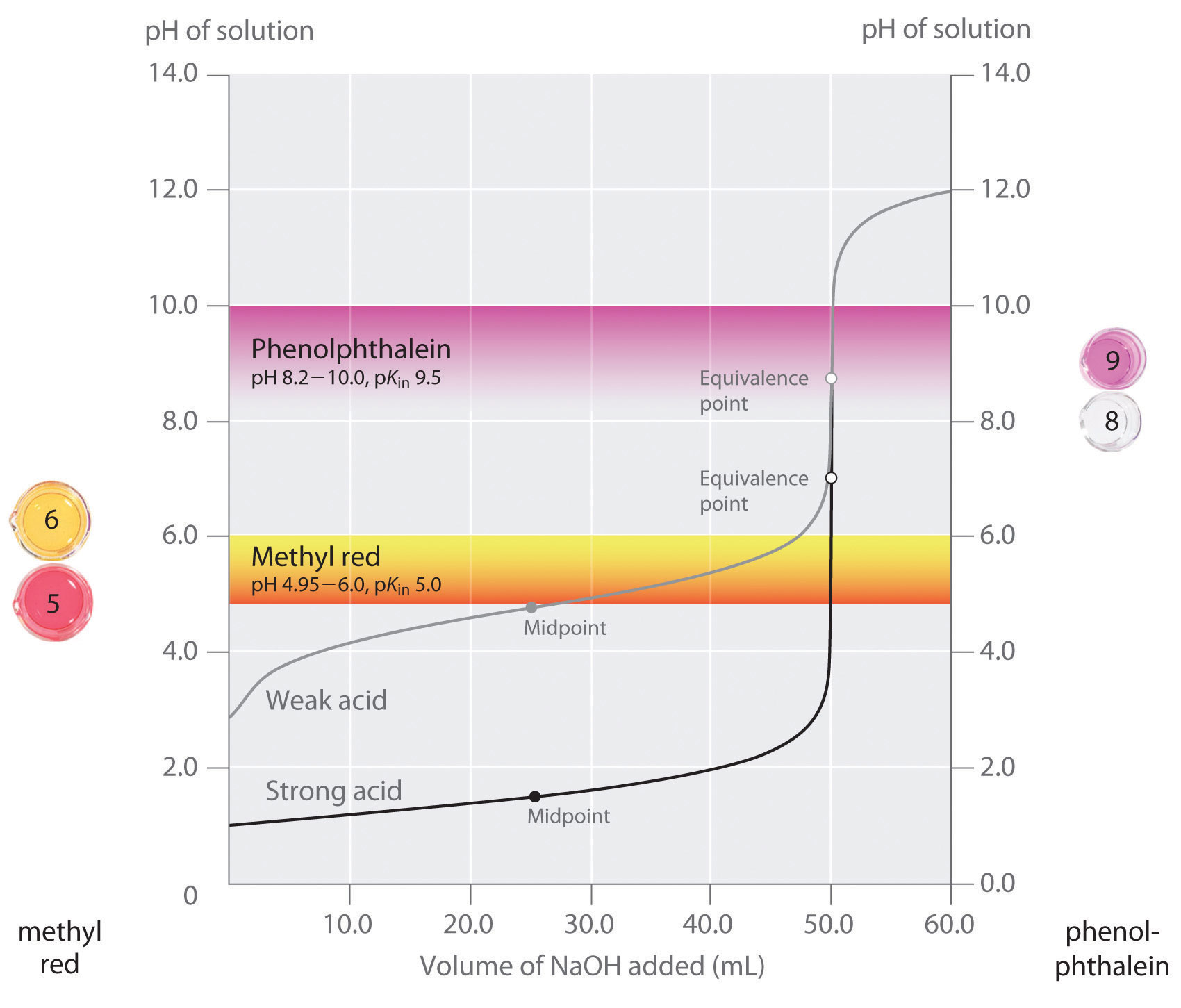
Il grafico mostra i risultati ottenuti utilizzando due indicatori (rosso metile e fenolftaleina) per la titolazione di soluzioni 0,100 M di un acido forte (HCl) e un acido debole (acido acetico) con 0,100 M \(NaOH\). A causa della ripidità della curva di titolazione di un acido forte intorno al punto di equivalenza, entrambi gli indicatori cambieranno rapidamente colore al punto di equivalenza per la titolazione dell’acido forte. Al contrario, il pKin per il rosso metile (5.0) è molto vicino al pKa dell’acido acetico (4.76); il punto medio del cambiamento di colore per il rosso metile si verifica vicino al punto medio della titolazione, piuttosto che al punto di equivalenza.
In generale, per titolazioni di acidi forti con basi forti (e viceversa), qualsiasi indicatore con un pK tra circa 4.0 e 10.0 andrà bene. Per la titolazione di un acido debole, tuttavia, il pH al punto di equivalenza è maggiore di 7,0, quindi un indicatore come la fenolftaleina o il blu di timolo, con pKin > 7,0, dovrebbe essere usato. Al contrario, per la titolazione di una base debole, dove il pH al punto di equivalenza è inferiore a 7,0, un indicatore come il rosso metile o il blu di bromocresolo, con pKin < 7.0, dovrebbe essere usato.
Esempio \(\PageIndex{1})
Nella titolazione di un acido debole con una base forte, quale indicatore sarebbe la scelta migliore?
- Arancio metile
- Verde di bromocresolo
- Fenolftaleina
Soluzione
La risposta corretta è C. Nella titolazione di un acido debole con una base forte, la base coniugata dell’acido debole renderà il pH al punto di equivalenza maggiore di 7. Pertanto, si desidera che un indicatore cambi in quell’intervallo di pH. Sia l’arancio di metile che il verde di bromocresolo cambiano colore in un intervallo di pH acido, mentre la fenolftaleina cambia in un intervallo di pH basico.
L’esistenza di molti diversi indicatori con diversi colori e valori di pKin fornisce anche un modo conveniente per stimare il pH di una soluzione senza usare un costoso misuratore elettronico di pH e un fragile elettrodo di pH. Strisce di carta o di plastica impregnate di combinazioni di indicatori sono usate come “carta pH”, che permette di stimare il pH di una soluzione semplicemente immergendovi un pezzo di carta pH e confrontando il colore risultante con gli standard stampati sul contenitore (Figura \(\PageIndex{4})).
Sommario
Gli indicatori acido-base sono composti che cambiano colore ad un particolare pH. Sono tipicamente acidi o basi deboli i cui cambiamenti di colore corrispondono alla deprotonazione o protonazione dell’indicatore stesso.
Contribuenti e attribuzioni
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) e Richard Langley (Stephen F. Austin State University) con autori collaboratori. Il contenuto del libro di testo prodotto da OpenStax College è concesso in licenza Creative Commons Attribution License 4.0. Scarica gratuitamente all’indirizzo http://cnx.org/contents/85abf193-2bd…[email protected]).
- {template.ContribBoundless()}}