Effetto fotoelettrico
Albert Einstein dimostrò che la dipendenza dalla frequenza non poteva essere giustificata dalla sola teoria classica delle onde, quindi fornì una prospettiva particellare. Nel 1905 dichiarò che i fotoni (chiamati da G.N. Lewis), erano “particelle di luce” che avevano un’energia simile a quella dell’equazione di Planck. Questa equazione afferma che la frequenza e l’energia di un quantum di radiazione elettromagnetica sono proporzionali. L’idea di Einstein fu rivoluzionaria perché portò una nuova prospettiva nel guardare la luce non solo come un’onda, ma come una particella.
L’equazione di Planck: E=hv Costante di Planck: h=6,626×10-34 Js 
Il fenomeno dell’effetto fotoelettrico, secondo cui gli elettroni vengono emessi quando la luce colpisce la superficie dei metalli, fu scoperto da Heinrich Hertz nel 1888. Questo processo si verifica quando la luce incidente ha una frequenza superiore a un certo valore di soglia. La quantità di elettroni espulsi è determinata dall’intensità della luce incidente, tuttavia, la frequenza della luce influisce sulle energie cinetiche degli elettroni emessi.
In altre parole, l’intensità può essere descritta come la luminosità di una fonte di luce. Quindi, aumentando la luminosità, l’intensità aumenta, e così l’energia rilasciata. L’energia rilasciata sarà maggiore e quando questo accade l’ampiezza dell’onda luminosa aumenta. Ma non importa quanto aumenta l’energia o quanto si aumenta l’ampiezza quando si cerca di emettere elettroni da una superficie metallica. Per farlo, la frequenza deve aumentare.
Aumenta la luminosità (mantiene frequenza ed energia)–>Aumenta l’intensità (aumenta#di fot >Aumenta il numero di elettroni emessi
>Aumenta il numero di elettroni emessi
Aumenta la frequenza–>Aumenta l’energia cinetica degli elettroni
La spiegazione di Einstein fu che la luce aveva la caratteristica di una particella (fotone) con l’energia fotonica di E=hv. Ha concluso che se la frequenza di soglia del metallo è maggiore della frequenza del fotone, allora il fotone non avrà alcun effetto quando bombarda la superficie metallica. Tuttavia, se il fotone raggiunge la frequenza di soglia, potrebbe causare l’emissione di un elettrone. Per emettere più elettroni, la fonte di luce deve essere illuminata per aumentare l’intensità, che mantiene ancora la frequenza della luce e la stessa energia, ma aumenta il numero di fotoni.
Frequenza di soglia: Vo= (eVo)/h = funzione di lavoro/costante di Planck
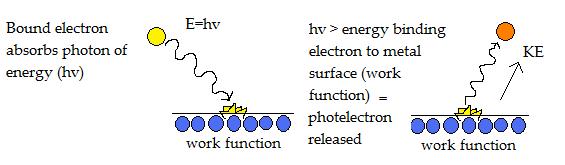
L’effetto fotoelettrico può verificarsi anche con la luce a frequenza più bassa, chiamata frequenza di soglia.
Glihotelectron vengono rilasciati quando l’energia del fotone (hv) è maggiore della funzione di lavoro. L’energia in eccesso viene rilasciata come energia cinetica nel fotoelettrone espulso ed è proporzionale alla frequenza della luce.
Il diagramma sopra illustra un elettrone colpito da un fotone di energia, che gli permette di superare la funzione di lavoro che lo lega alla superficie del metallo. Come risultato, viene emesso un fotoelettrone con energia cinetica.
Applicando la legge di conservazione dell’energia otteniamo l’equazione: hv =eVo+(1/2)mv2
Per riassumere, indipendentemente dall’intensità della luce, nessun elettrone sarà emesso se la frequenza della luce è inferiore alla frequenza di soglia (Vo) della superficie metallica.

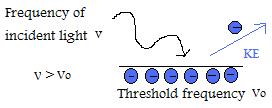
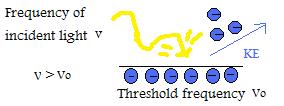
- Se la frequenza della luce incidente è superiore alla frequenza di soglia, allora l’energia cinetica della particella emessa aumenterà linearmente rispetto alla grandezza della frequenza.
- Se la frequenza della luce incidente è maggiore della frequenza di soglia, il numero di elettroni emessi è determinato dall’intensità. (NOTA IMPORTANTE: L’energia cinetica per elettrone non cambia se l’intensità è cambiata, solo quando la frequenza è manipolata)
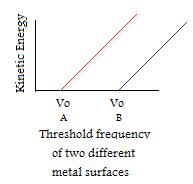
- Anche se ogni metallo ha la sua unica frequenza di soglia, tutti hanno modelli simili.