Leerdoelen
- Licht de functie en kleurveranderingen van zuur-base-indicatoren toe
- Demonstreer hoe je de juiste indicator selecteert voor een titratie-experiment
- Bepaal de zure dissociatieconstanten Ka of Kai van indicatoren.
Zekere organische stoffen veranderen in verdunde oplossing van kleur wanneer de concentratie hydroniumionen een bepaalde waarde bereikt. Fenolftaleïne is bijvoorbeeld een kleurloze stof in elke waterige oplossing met een hydroniumionconcentratie groter dan 5,0 × 10-9 M (pH < 8,3). In meer basische oplossingen met een hydroniumionconcentratie van minder dan 5,0 × 10-9 M (pH > 8,3) is het rood of roze. Stoffen zoals fenolftaleïne, die kunnen worden gebruikt om de pH van een oplossing te bepalen, worden zuur-base-indicatoren genoemd. Zuur-base-indicatoren zijn ofwel zwakke organische zuren ofwel zwakke organische basen.
Het evenwicht in een oplossing van de zuur-base-indicator methyloranje, een zwak zuur, kan worden weergegeven door een vergelijking waarin we HIn gebruiken als eenvoudige weergave voor het complexe methyloranje molecuul:
\}{}}=4.0×10^{-4}}
Het anion van methyloranje, In-, is geel en de niet-geïoniseerde vorm, HIn, is rood. Wanneer we zuur toevoegen aan een oplossing van methyloranje, verschuift het evenwicht door de verhoogde concentratie hydroniumionen naar de niet-geïoniseerde rode vorm, volgens het principe van Le Chatelier. Als we base toevoegen, verschuift het evenwicht in de richting van de gele vorm. Dit gedrag is volledig analoog aan de werking van buffers.
De kleur van een indicator is het zichtbare resultaat van de verhouding tussen de concentraties van de twee soorten In- en HIn. Als het grootste deel van de indicator (meestal ongeveer 60-90% of meer) aanwezig is als In-, dan zien we de kleur van het In-ion, dat geel zou zijn voor methyloranje. Als het grootste deel aanwezig is als HIn, dan zien we de kleur van het HIn-molecuul: rood voor methyloranje. Voor methyloranje kunnen we de vergelijking voor Ka herschikken en schrijven:
\}{}={K}_a}{}}]
Dit laat ons zien hoe de verhouding van \(\ce{K}{}}) varieert met de concentratie van het hydroniumion. De bovenstaande uitdrukking die het indicator-evenwicht beschrijft, kan herschikt worden:
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:,,pH=p[mathit{K}_a+logellinks(\dfrac{}{}})}]
De laatste formule is dezelfde als de Henderson-Hasselbalch-vergelijking, waarmee het evenwicht van indicatoren kan worden beschreven.
Wanneer de verhouding tot dezelfde numerieke waarde heeft als Ka, is deze gelijk aan 1, wat betekent dat 50% van de indicator aanwezig is in de rode vorm (HIn) en 50% in de gele ionische vorm (In-), en dat de oplossing oranje van kleur is. Wanneer de concentratie hydroniumionen stijgt tot 8 × 10-4 M (een pH van 3,1), wordt de oplossing rood. Bij een verdere toename van de hydroniumionconcentratie (daling van de pH) is geen kleurverandering zichtbaar. Bij een hydroniumionconcentratie van 4 × 10-5 M (een pH van 4,4) bevindt het grootste deel van de indicator zich in de gele ionische vorm en geeft een verdere daling van de hydroniumionconcentratie (stijging van de pH) geen zichtbare kleurverandering. Het pH-bereik tussen 3,1 (rood) en 4,4 (geel) is het kleurveranderingsinterval van methyloranje; de uitgesproken kleurverandering vindt plaats tussen deze pH-waarden.
Er kunnen veel verschillende stoffen als indicator worden gebruikt, afhankelijk van de specifieke reactie die moet worden gecontroleerd. Zo bevat rodekoolsap een mengsel van gekleurde stoffen die veranderen van dieprood bij lage pH via lichtblauw bij tussenliggende pH naar geel bij hoge pH (figuur). In alle gevallen moet een goede indicator echter de volgende eigenschappen hebben:
- De kleurverandering moet gemakkelijk waarneembaar zijn.
- De kleurverandering moet snel zijn.
- Het indicatormolecuul mag niet reageren met de stof die getitreerd wordt.
- Om fouten tot een minimum te beperken, moet de indicator een pKin hebben die binnen één pH-eenheid ligt van de verwachte pH op het equivalentiepunt van de titratie.

Rode koolsap bevat een mengsel van stoffen waarvan de kleur afhangt van de pH. Elke reageerbuis bevat een oplossing van rodekoolsap in water, maar de pH van de oplossingen varieert van pH = 2,0 (uiterst links) tot pH = 11,0 (uiterst rechts). Bij pH = 7,0 is de oplossing blauw.
Synthetische indicatoren zijn ontwikkeld die aan deze criteria voldoen en vrijwel het gehele pH-bereik bestrijken. In figuur is bij benadering het pH-bereik te zien waarbinnen enkele veelgebruikte indicatoren van kleur veranderen en hun kleurverandering. Bovendien zijn sommige indicatoren (zoals thymolblauw) polyprotische zuren of basen, die tweemaal van kleur veranderen bij ver uit elkaar liggende pH-waarden.
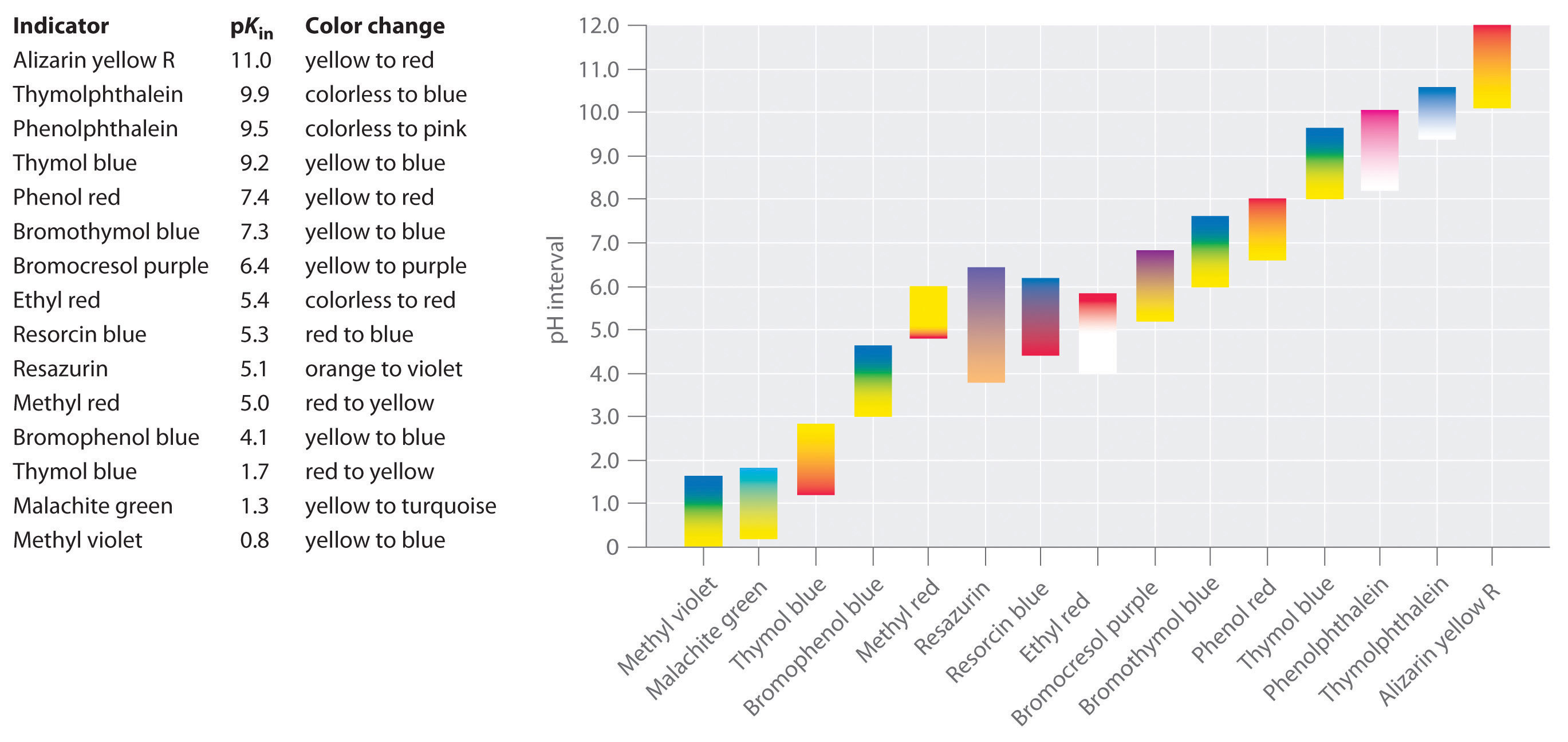
Het is belangrijk om te weten dat een indicator niet abrupt van kleur verandert bij een bepaalde pH-waarde; in plaats daarvan ondergaat hij in feite een pH-titratie, net als elk ander zuur of base. Naarmate de concentratie van HIn afneemt en de concentratie van In- toeneemt, verandert de kleur van de oplossing langzaam van de karakteristieke kleur van HIn naar die van In-. Zoals we in hoofdstuk 16 zullen zien, verandert de / verhouding van 0,1 bij een pH één eenheid onder pKin tot 10 bij een pH één eenheid boven pKin. De meeste indicatoren veranderen dus van kleur over een pH-bereik van ongeveer twee pH-eenheden.
We hebben gesteld dat een goede indicator een pKin-waarde moet hebben die dicht bij de verwachte pH bij het equivalentiepunt ligt. Voor een titratie van sterk zuur en sterk base is de keuze van de indicator niet bijzonder kritisch vanwege de zeer grote verandering in pH die optreedt rond het equivalentiepunt. Daarentegen kan het gebruik van de verkeerde indicator bij een titratie van een zwak zuur of een zwakke base tot relatief grote fouten leiden, zoals in figuur wordt geïllustreerd. Deze figuur toont grafieken van de pH tegen het volume van de toegevoegde base voor de titratie van 50,0 mL van een 0,100 M oplossing van een sterk zuur (HCl) en een zwak zuur (azijnzuur) met 0,100 M (NaOH). De pH-gebieden waarbij twee gebruikelijke indicatoren (methylrood, (pK) = 5,0), en fenolftaleïne, (pK) = 9,5)) van kleur veranderen zijn ook aangegeven. De horizontale balken geven het pH-bereik aan waarbij beide indicatoren van kleur veranderen en kruisen de HCl-titratiecurve, waar deze bijna verticaal is. Beide indicatoren veranderen dus van kleur wanneer in wezen hetzelfde volume NaOH is toegevoegd (ongeveer 50 mL), hetgeen overeenkomt met het equivalentiepunt. Daarentegen zal de titratie van azijnzuur zeer verschillende resultaten geven naargelang methylrood of fenolftaleïne als indicator wordt gebruikt. Hoewel het pH-bereik waarin fenolftaleïne van kleur verandert iets groter is dan de pH bij het equivalentiepunt van de sterkzurige titratie, zal de fout verwaarloosbaar zijn door de helling van dit deel van de titratiecurve. Net als bij de HCl-titratie zal de fenolftaleïne-indicator roze kleuren wanneer ongeveer 50 mL NaOH aan de azijnzuuroplossing is toegevoegd. Daarentegen begint methylrood van rood naar geel te verkleuren rond pH 5, wat in de buurt ligt van het middelpunt van de azijnzuurtitratie, niet het equivalentiepunt. Het toevoegen van slechts ongeveer 25-30 mL NaOH zal er dus voor zorgen dat de methylroodindicator van kleur verandert, wat resulteert in een enorme fout.
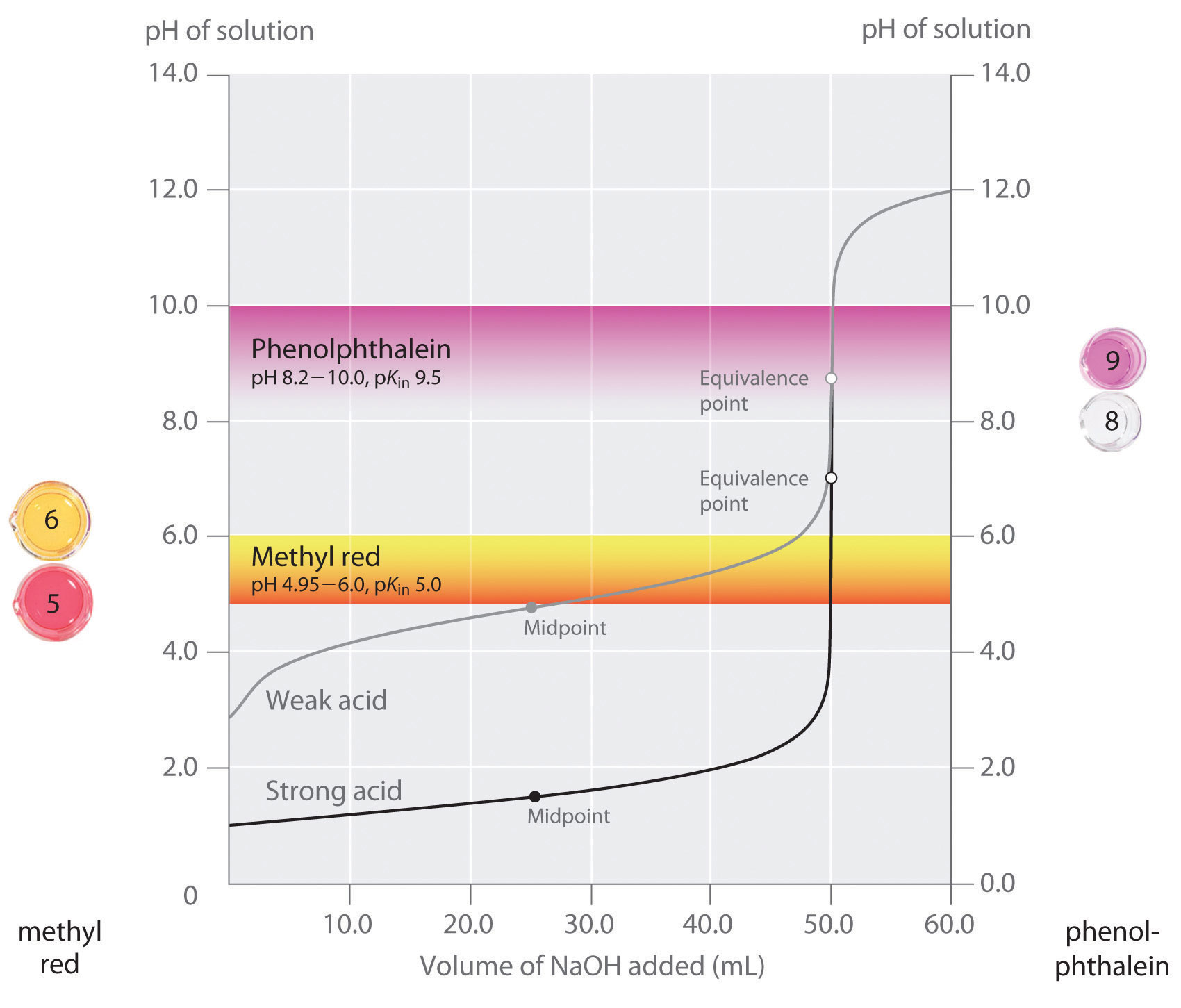
De grafiek toont de resultaten die zijn verkregen met twee indicatoren (methylrood en fenolftaleïne) voor de titratie van 0,100 M oplossingen van een sterk zuur (HCl) en een zwak zuur (azijnzuur) met 0,100 M natriumhydroxide (NaOH). Door de steilheid van de titratiecurve van een sterk zuur rond het equivalentiepunt zullen beide indicatoren snel van kleur veranderen bij het equivalentiepunt voor de titratie van het sterke zuur. Daarentegen ligt de pKin van methylrood (5,0) zeer dicht bij de pKa van azijnzuur (4,76); het middenpunt van de kleurverandering voor methylrood ligt bij het middenpunt van de titratie en niet bij het equivalentiepunt.
In het algemeen is voor titraties van sterke zuren met sterke basen (en vice versa) elke indicator met een pK tussen ongeveer 4,0 en 10,0 goed genoeg. Voor de titratie van een zwak zuur is de pH bij het equivalentiepunt echter groter dan 7,0, zodat een indicator zoals fenolftaleïne of thymolblauw, met een pKin > 7,0, moet worden gebruikt. Omgekeerd moet voor de titratie van een zwakke base, waarbij de pH bij het equivalentiepunt lager is dan 7,0, een indicator zoals methylrood of broomkresolblauw, met pKin < 7.0, worden gebruikt.
PageIndex{1})
Bij de titratie van een zwak zuur met een sterke base, welke indicator is dan de beste keuze?
- Methyl Orange
- Bromocresol Green
- Phenolphtalein
Oplossing
Het juiste antwoord is C. Bij de titratie van een zwak zuur met een sterke base zal de geconjugeerde base van het zwakke zuur de pH bij het equivalentiepunt groter maken dan 7. Daarom zou je een indicator willen die in dat pH-bereik verandert. Zowel methyloranje als broomkresolgroen veranderen van kleur in een zuur pH-bereik, terwijl fenolftaleïne verandert in een basische pH.
Het bestaan van veel verschillende indicatoren met verschillende kleuren en pKin-waarden biedt ook een handige manier om de pH van een oplossing te schatten zonder een dure elektronische pH-meter en een breekbare pH-elektrode te hoeven gebruiken. Papier of plastic strips geïmpregneerd met combinaties van indicatoren worden gebruikt als “pH-papier,” waarmee je de pH van een oplossing kunt schatten door er simpelweg een stukje pH-papier in te dopen en de resulterende kleur te vergelijken met de standaarden die op de verpakking staan afgedrukt (Figuur \(\PageIndex{4})).
Samenvatting
Zuur-base-indicatoren zijn verbindingen die bij een bepaalde pH van kleur veranderen. Het zijn meestal zwakke zuren of basen waarvan de kleurverandering overeenkomt met deprotonatie of protonatie van de indicator zelf.
Bijdragers en toeschrijvingen
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) en Richard Langley (Stephen F. Austin State University) met bijdragende auteurs. Inhoud van het tekstboek geproduceerd door OpenStax College is gelicenseerd onder een Creative Commons Naamsvermelding Licentie 4.0 licentie. Gratis te downloaden op http://cnx.org/contents/85abf193-2bd…[email protected]).
- {template.ContribBoundless()}}