Zoals in de vorige paragrafen al is aangegeven, kunnen watermoleculen door de polaire watermolecule verbindingen met elkaar vormen. Deze bindingen worden waterstofbruggen genoemd. Als we kijken naar natriumchloride (zout), een verbinding die ionische bindingen bevat, dan kunnen we aantonen dat door eenvoudig tafelzout in bijvoorbeeld water te doen, we de elektrostatische aantrekkingskracht tussen de natrium- en chloride-ionen met een factor 80 kunnen verminderen. Naarmate meer natrium- en chloride-ionen vrijkomen door de verzwakking van de elektrostatische aantrekkingskracht die hen bijeenhoudt, worden zij omgeven door de polaire moleculen van water – wat “hydratatie” wordt genoemd.”

Water lost meer stoffen op dan enige andere gewone vloeistof door “zouten” te splitsen in samenstellende “ionen” (b.v. NaCl in Na+ en Cl-) en deze ionen te hydrateren om te voorkomen dat ze op elkaar inwerken. Polaire watermoleculen hebben dus een aantrekkingskracht op ionen (atomen of groepen atomen met een lading), waarbij “kationen” ionen met een positieve lading zijn en “anionen” een negatieve lading hebben. De meeste elementen hebben een hoge oplosbaarheid in water, wat betekent dat grote concentraties van die elementen kunnen ontstaan voordat het vermogen van de watermoleculen om de ionen te isoleren wordt overschreden. Het punt waarop Na en Cl, bijvoorbeeld, een zout beginnen neer te slaan in zeewater wordt “verzadiging” genoemd. Voor NaCl (het mineraal “haliet”) treedt dit alleen op in het huidige zeewater wanneer verdamping optreedt en het volume van het zeewater wordt gereduceerd tot ongeveer 10% van het oorspronkelijke volume.
Zeewater is in wezen een NaCl-oplossing met een gemiddelde concentratie van 35 g NaCl/kg water (of 3,5% zout). Na en Cl vormen meer dan 85% van het totaal aan opgeloste vaste stoffen (zout), maar er zijn nog andere belangrijke ionen aanwezig. De relatieve abundantie van ionen in zeewater is als volgt: Cl, Na, SO4, Mg, Ca, K. Samen vormen deze ionen >99% van de opgeloste vaste stoffen in zeewater. Met slechts vier andere elementen – HCO3 (bicarbonaat), Br, Sr, B, F – hebben we 99,99% van alle opgeloste vaste stoffen. De ladingen moeten in evenwicht zijn, dus de positieve lading van Na+, Mg+2, Ca+2, K+ is gelijk aan de negatieve lading van Cl-, SO4-2 (en HCO3-). Wij denken niet dat u het anders zou willen. Bedenk eens hoe de stroom van de zee naar u, zittend op het strand, zou zijn als de ladingen niet in evenwicht waren – schokkend!
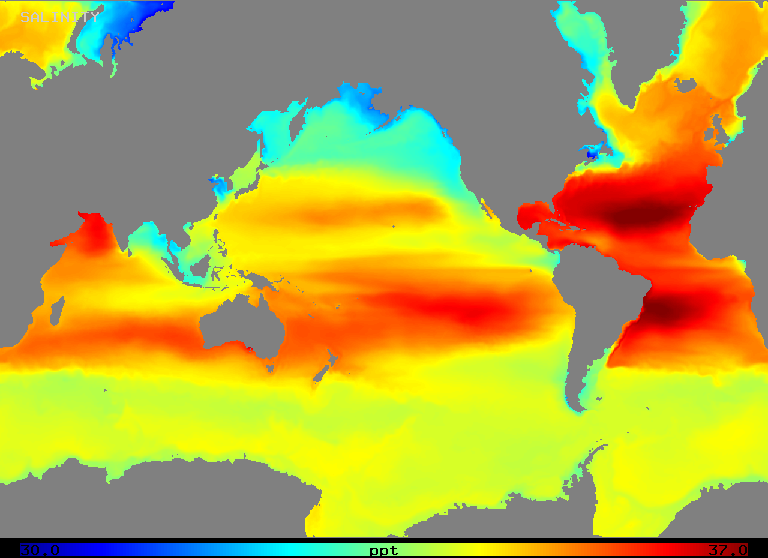
Het zoutgehalte varieert in de open oceaan over een bereik van ongeveer 32 tot 37 o/oo, zoals figuur 2 (hieronder) illustreert. Merk op dat gebieden met de hoogste saliniteit zich bevinden in gebieden met de hoogste netto verdamping, zoals men zou verwachten.
Alle andere opgeloste stoffen in het zeewater hebben zeer lage concentraties (deeltjes per miljoen of miljard) (ppm of ppb; 10-6 tot 10-9). Hieronder vallen belangrijke voedingsstoffen zoals fosfaat en nitraat, die door organismen worden gekringeld (elementen die “bio-limiterend” worden genoemd) en essentieel zijn voor het leven. Veel metalen hebben sporenconcentraties (wil je rijk worden? Er is ongeveer 9 miljoen ton goud opgelost in zeewater, wat ongeveer gelijk is aan al het goud dat in de loop van de geschiedenis op aarde is gedolven).
Zoals eerder aangegeven, ontstaat er bij verdamping van zeewater een voorspelbare opeenvolging van minerale zouten (mineralen raken op een gegeven moment verzadigd). Na verdamping van een paar % van de watermassa slaat CaCO3 (calciet) neer; na verdamping van 81% is CaSO4 (gips) volledig neergeslagen; na verdamping van ongeveer 90,5% is NaCl (haliet) volledig neergeslagen; bij 96% verdamping vallen de K- en Mg-zouten (w/ SO4 en Cl) uit. Er is genoeg zout in de oceaan om het land te bedekken met een laag van 170 m dik. Natuurlijke afzettingen van oude oceanen zoals deze worden “evaporieten” genoemd.