Objetivos de aprendizaje
- Explicar la función y los cambios de color de los indicadores ácido-base
- Demostrar cómo seleccionar el indicador adecuado para un experimento de valoración
- Determinar las constantes de disociación ácida Ka o Kai de los indicadores.
Ciertas sustancias orgánicas cambian de color en solución diluida cuando la concentración de iones hidronio alcanza un valor determinado. Por ejemplo, la fenolftaleína es una sustancia incolora en cualquier solución acuosa con una concentración de iones hidronio superior a 5,0 × 10-9 M (pH < 8,3). En soluciones más básicas en las que la concentración de iones hidronio es inferior a 5,0 × 10-9 M (pH > 8,3), es de color rojo o rosa. Las sustancias como la fenolftaleína, que pueden utilizarse para determinar el pH de una solución, se denominan indicadores ácido-base. Los indicadores ácido-base son ácidos orgánicos débiles o bases orgánicas débiles.
El equilibrio en una solución del indicador ácido-base naranja de metilo, un ácido débil, puede representarse mediante una ecuación en la que utilizamos el HIn como representación simple para la compleja molécula de naranja de metilo:
{}=4.0×10^{-4}]
El anión del naranja de metilo, In-, es amarillo, y la forma no ionizada, HIn, es roja. Cuando añadimos ácido a una solución de naranja de metilo, el aumento de la concentración de iones hidronio desplaza el equilibrio hacia la forma roja no ionizada, de acuerdo con el principio de Le Chatelier. Si añadimos base, desplazamos el equilibrio hacia la forma amarilla. Este comportamiento es completamente análogo a la acción de los tampones.
El color de un indicador es el resultado visible de la relación de las concentraciones de las dos especies In- y HIn. Si la mayor parte del indicador (normalmente alrededor del 60-90% o más) está presente como In-, entonces vemos el color del ion In-, que sería amarillo para el naranja de metilo. Si la mayor parte está presente como HIn, entonces vemos el color de la molécula de HIn: rojo para el naranja de metilo. Para el naranja de metilo, podemos reordenar la ecuación para Ka y escribir:
{}=dfrac{}=dfrac{{mathit{K}_a}}]
Esto nos muestra cómo varía la relación de \ce{dfrac{}} con la concentración de ion hidronio. La expresión anterior que describe el equilibrio del indicador puede reordenarse:
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:o:pH=p\mathit{K}_a+log\left(\dfrac{}{}right)}]
La última fórmula es la misma que la ecuación de Henderson-Hasselbalch, que puede utilizarse para describir el equilibrio de los indicadores.
Cuando tiene el mismo valor numérico que Ka, la relación de a es igual a 1, lo que significa que el 50% del indicador está presente en la forma roja (HIn) y el 50% está en la forma iónica amarilla (In-), y la solución aparece de color naranja. Cuando la concentración de iones hidronio aumenta hasta 8 × 10-4 M (un pH de 3,1), la solución se vuelve roja. No se aprecia ningún cambio de color si la concentración de iones de hidronio sigue aumentando (disminución del pH). A una concentración de iones de hidronio de 4 × 10-5 M (un pH de 4,4), la mayor parte del indicador se encuentra en la forma iónica amarilla, y una nueva disminución de la concentración de iones de hidronio (aumento del pH) no produce un cambio de color visible. El intervalo de pH entre 3,1 (rojo) y 4,4 (amarillo) es el intervalo de cambio de color del naranja de metilo; el cambio de color pronunciado tiene lugar entre estos valores de pH.
Se pueden utilizar muchas sustancias diferentes como indicadores, dependiendo de la reacción concreta que se desee controlar. Por ejemplo, el zumo de lombarda contiene una mezcla de sustancias coloreadas que cambian de rojo intenso a pH bajo a azul claro a pH intermedio y a amarillo a pH alto (Figura \(\PageIndex{1})). En todos los casos, sin embargo, un buen indicador debe tener las siguientes propiedades:
- El cambio de color debe ser fácilmente detectable.
- El cambio de color debe ser rápido.
- La molécula del indicador no debe reaccionar con la sustancia que se está valorando.
- Para minimizar los errores, el indicador debe tener un pKin que esté dentro de una unidad de pH del pH esperado en el punto de equivalencia de la valoración.

El zumo de lombarda contiene una mezcla de sustancias cuyo color depende del pH. Cada tubo de ensayo contiene una solución de zumo de lombarda en agua, pero el pH de las soluciones varía de pH = 2,0 (extremo izquierdo) a pH = 11,0 (extremo derecho). A pH = 7,0, la solución es azul.
Se han desarrollado indicadores sintéticos que cumplen estos criterios y cubren prácticamente todo el rango de pH. La figura \(\PageIndex{2}) muestra el rango de pH aproximado en el que algunos indicadores comunes cambian de color y su cambio de color. Además, algunos indicadores (como el azul de timol) son ácidos o bases polipróticos, que cambian de color dos veces a valores de pH muy separados.
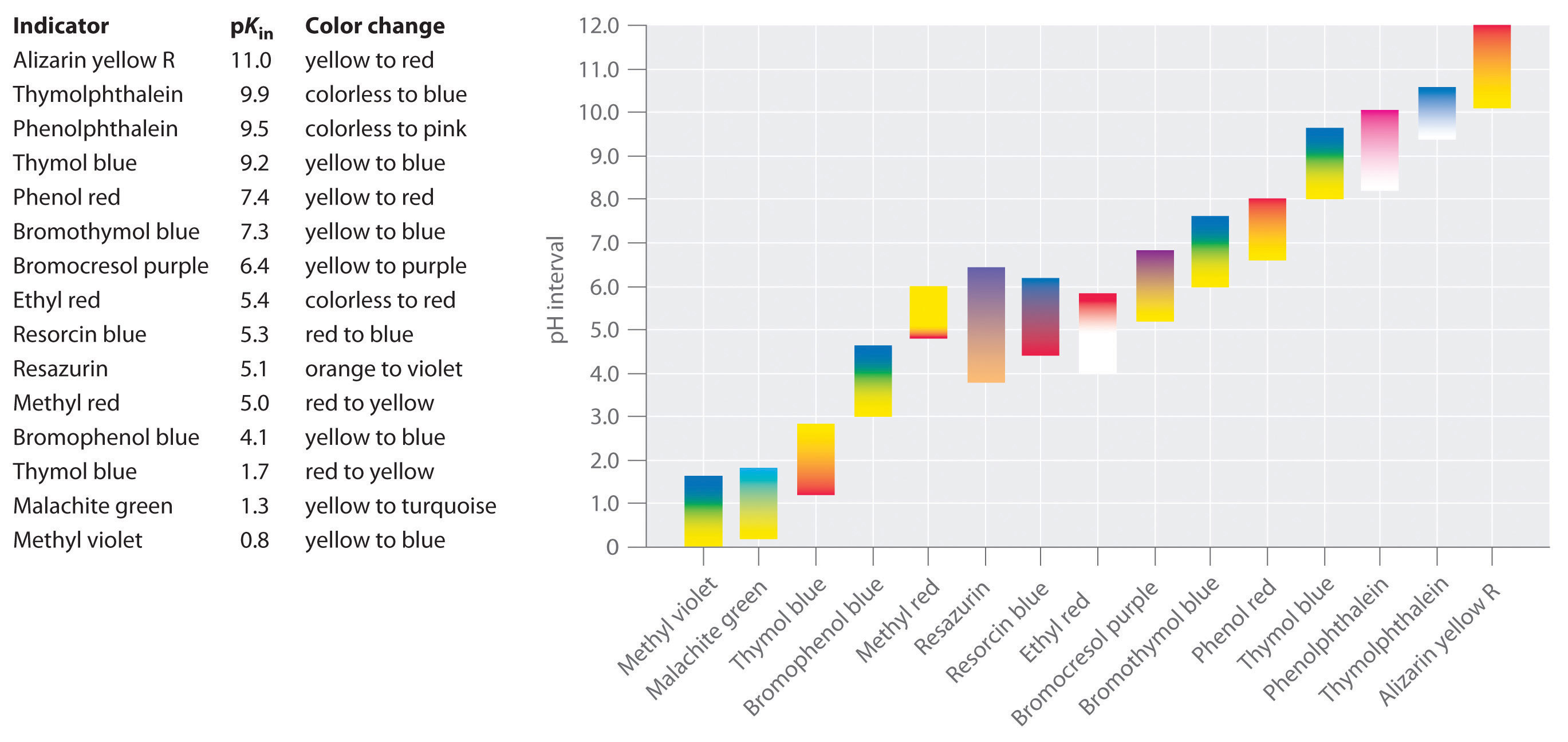
Es importante saber que un indicador no cambia de color bruscamente en un valor de pH concreto, sino que en realidad experimenta una valoración del pH como cualquier otro ácido o base. A medida que la concentración de HIn disminuye y la de In- aumenta, el color de la solución cambia lentamente del color característico del HIn al del In-. Como veremos en la sección 16, la relación / cambia de 0,1 a un pH una unidad por debajo de pKin a 10 a un pH una unidad por encima de pKin. Por lo tanto, la mayoría de los indicadores cambian de color en un rango de pH de aproximadamente dos unidades de pH.
Hemos afirmado que un buen indicador debe tener un valor de pKin que se acerque al pH esperado en el punto de equivalencia. Para una valoración de ácido fuerte-base fuerte, la elección del indicador no es especialmente crítica debido al gran cambio de pH que se produce alrededor del punto de equivalencia. Por el contrario, el uso de un indicador incorrecto para una valoración de un ácido débil o una base débil puede dar lugar a errores relativamente grandes, como se ilustra en la Figura \ (\PageIndex{3}). Esta figura muestra los gráficos del pH en función del volumen de la base añadida para la valoración de 50,0 mL de una solución 0,100 M de un ácido fuerte (HCl) y de un ácido débil (ácido acético) con 0,100 M \(NaOH\). También se muestran los rangos de pH en los que cambian de color dos indicadores habituales (rojo de metilo, \_K_{in} = 5,0\_), y fenolftaleína, \_K_{in} = 9,5\_). Las barras horizontales indican los rangos de pH en los que ambos indicadores cambian de color cruzando la curva de valoración de HCl, donde es casi vertical. Por tanto, ambos indicadores cambian de color cuando se ha añadido esencialmente el mismo volumen de \N(NaOH\) (unos 50 mL), lo que corresponde al punto de equivalencia. En cambio, la valoración del ácido acético dará resultados muy diferentes según se utilice como indicador el rojo de metilo o la fenolftaleína. Aunque el intervalo de pH en el que la fenolftaleína cambia de color es ligeramente mayor que el pH en el punto de equivalencia de la valoración del ácido fuerte, el error será insignificante debido a la pendiente de esta parte de la curva de valoración. Al igual que en la valoración con HCl, el indicador de fenolftaleína se volverá rosa cuando se hayan añadido unos 50 mL de \N(NaOH\) a la solución de ácido acético. En cambio, el rojo de metilo empieza a cambiar de rojo a amarillo alrededor del pH 5, que está cerca del punto medio de la valoración del ácido acético, no del punto de equivalencia. Por lo tanto, añadir sólo unos 25-30 mL de \N(NaOH\) hará que el indicador de rojo de metilo cambie de color, dando lugar a un gran error.
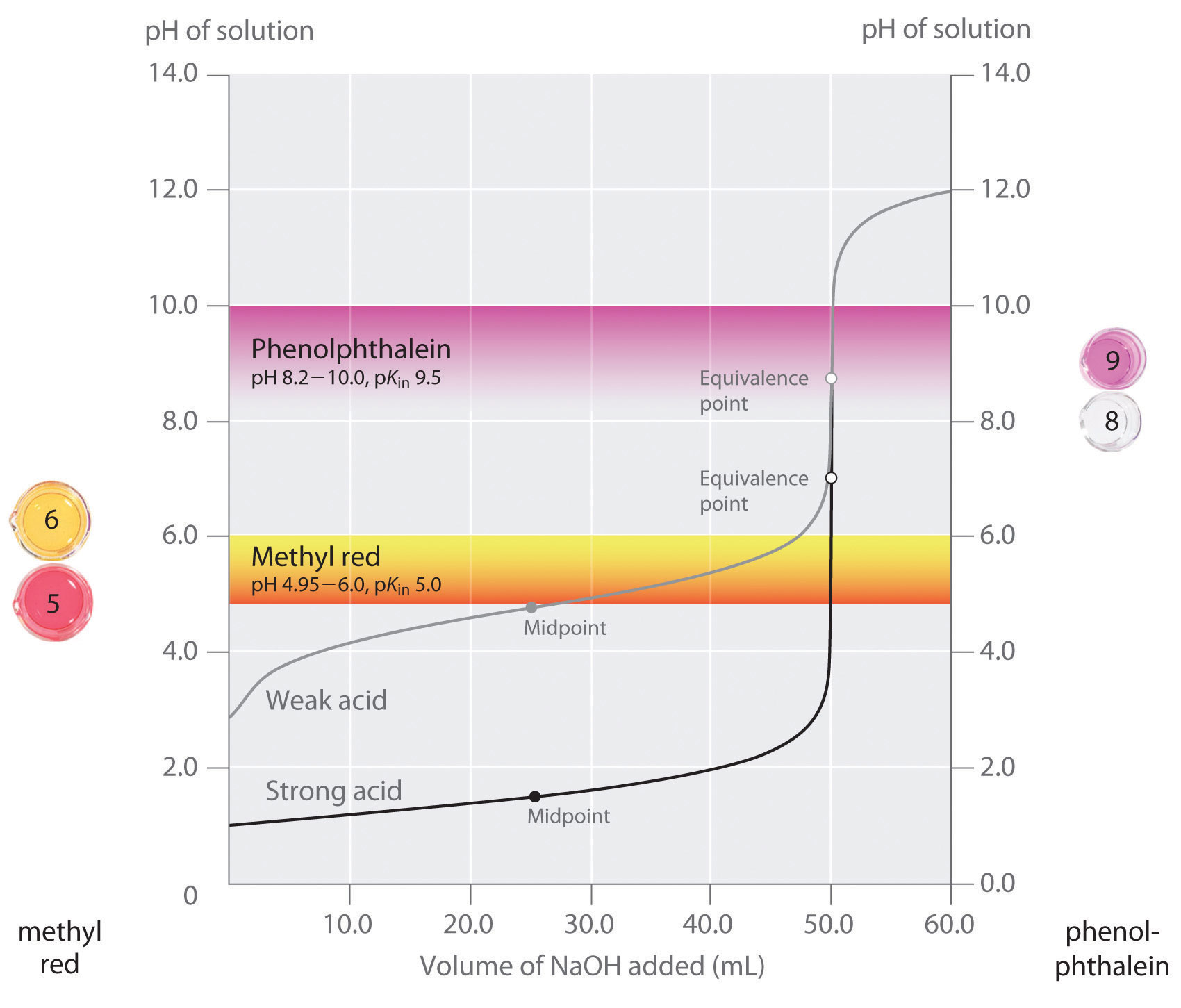
El gráfico muestra los resultados obtenidos utilizando dos indicadores (rojo de metilo y fenolftaleína) para la valoración de soluciones 0,100 M de un ácido fuerte (HCl) y un ácido débil (ácido acético) con 0,100 M de \N(NaOH\). Debido a la inclinación de la curva de valoración de un ácido fuerte alrededor del punto de equivalencia, cualquiera de los indicadores cambiará rápidamente de color en el punto de equivalencia para la valoración del ácido fuerte. Por el contrario, el pKin del rojo de metilo (5,0) está muy cerca del pKa del ácido acético (4,76); el punto medio del cambio de color del rojo de metilo se produce cerca del punto medio de la valoración, en lugar de en el punto de equivalencia.
En general, para las valoraciones de ácidos fuertes con bases fuertes (y viceversa), cualquier indicador con un pK entre aproximadamente 4,0 y 10,0 servirá. Sin embargo, para la valoración de un ácido débil, el pH en el punto de equivalencia es superior a 7,0, por lo que debe utilizarse un indicador como la fenolftaleína o el azul de timol, con pKin > 7,0. Por el contrario, para la valoración de una base débil, cuando el pH en el punto de equivalencia es inferior a 7,0, debe utilizarse un indicador como el rojo de metilo o el azul de bromocresol, con pKin < 7.0, debe utilizarse.
Ejemplo (\PageIndex{1})
En la valoración de un ácido débil con una base fuerte, ¿qué indicador sería la mejor elección?
- Naranja de metilo
- Verde de bromocresol
- Fenolftaleína
-
Paul Flowers (Universidad de Carolina del Norte – Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Universidad Estatal Stephen F. Austin) con autores colaboradores. El contenido del libro de texto producido por OpenStax College se encuentra bajo una licencia Creative Commons Attribution License 4.0. Descárguelo gratuitamente en http://cnx.org/contents/85abf193-2bd…[email protected]).
- {template.ContribBoundless()}}
Solución
La respuesta correcta es la C. En la valoración de un ácido débil con una base fuerte, la base conjugada del ácido débil hará que el pH en el punto de equivalencia sea mayor que 7. Por lo tanto, se querrá un indicador que cambie en ese rango de pH. Tanto el naranja de metilo como el verde de bromocresol cambian de color en un rango de pH ácido, mientras que la fenolftaleína cambia en un pH básico.
Resumen
Los indicadores ácido-base son compuestos que cambian de color a un pH determinado. Suelen ser ácidos o bases débiles cuyos cambios de color corresponden a la desprotonación o protonación del propio indicador.