Efecto fotoeléctrico
Albert Einstein demostró que la dependencia de la frecuencia no podía justificarse sólo con la teoría ondulatoria clásica, por lo que aportó una perspectiva de partícula. En 1905 declaró que los fotones (llamados así por G.N. Lewis), eran «partículas de luz» que tenían una energía similar a la de la ecuación de Planck. Esta ecuación establece que la frecuencia y la energía de un cuanto de radiación electromagnética son proporcionales. La idea de Einstein fue revolucionaria porque aportó una nueva perspectiva al ver la luz no sólo como una onda, sino como una partícula.
Ecuación de Planck: E=hv Constante de Planck: h=6,626×10-34 Js 
El fenómeno del efecto fotoeléctrico por el que se emiten electrones cuando la luz incide en la superficie de los metales fue descubierto por Heinrich Hertz en 1888. Este proceso se produce cuando la luz incidente tiene una frecuencia superior a un determinado valor umbral. La cantidad de electrones expulsados está determinada por la intensidad de la luz incidente, sin embargo, la frecuencia de la luz afecta a las energías cinéticas de los electrones emitidos.
En otras palabras, la intensidad puede describirse como el brillo de una fuente de luz. Así que al aumentar el brillo, la intensidad aumenta y también la energía liberada. La salida de energía será mayor y cuando esto ocurre la amplitud de la onda luminosa aumenta. Pero no importa cuánto se aumente la energía o cuánto se aumente la amplitud cuando se trata de emitir electrones desde una superficie metálica. Para ello, la frecuencia debe aumentar.
Aumenta el brillo (mantiene la frecuencia y la energía)–>Aumenta la intensidad (aumenta#de fot ons)–>Aumenta el # de electrones emitidos
ons)–>Aumenta el # de electrones emitidos
Aumenta la frecuencia–>Aumenta la energía cinética de los electrones
La explicación de Einstein fue que la luz tenía la característica de una partícula (fotón) con la energía del fotón de E=hv. Llegó a la conclusión de que si la frecuencia umbral del metal era mayor que la frecuencia del fotón, entonces el fotón no tendría ningún efecto cuando bombardeara la superficie del metal. Sin embargo, si el fotón alcanzaba la frecuencia umbral, podía provocar la emisión de un electrón. Para emitir más electrones, la fuente de luz debe ser iluminada para aumentar la intensidad, lo que sigue manteniendo la frecuencia de la luz y la misma energía, pero aumenta el número de fotones.
Frecuencia umbral: Vo= (eVo)/h = función de trabajo/Constante de Planck
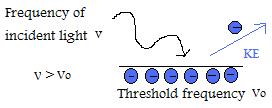
El efecto fotoeléctrico puede producirse incluso con la luz de menor frecuencia llamada frecuencia umbral.
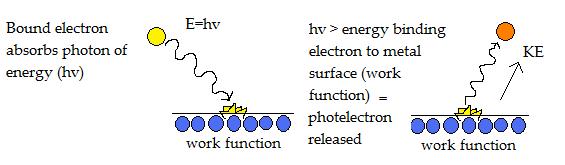
Los fototelectrones se liberan cuando la energía del fotón (hv) es mayor que la función de trabajo. La energía en exceso se libera como energía cinética en el fotoelectrón expulsado y es proporcional a la frecuencia de la luz.
El diagrama anterior ilustra un electrón que es golpeado por un fotón de energía, lo que le permite superar la función de trabajo que lo une a la superficie del metal. Como resultado, se emite un fotoelectrón con energía cinética.
Aplicando la ley de conservación de la energía obtenemos la ecuación: hv =eVo+(1/2)mv2
Para resumir, independientemente de la intensidad de la luz, no se emitirán electrones si la frecuencia de la luz está por debajo de la frecuencia umbral (Vo) de la superficie metálica.

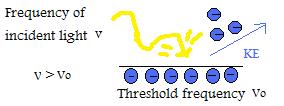
- Si la frecuencia de la luz incidente está por encima de la frecuencia umbral,entonces la energía cinética de la partícula emitida aumentará linealmente respecto a la magnitud de la frecuencia.
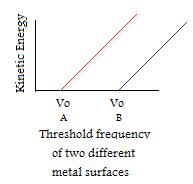
- Si la frecuencia de la luz incidente es mayor que la frecuencia umbral, el número de electrones emitidos está determinado por la intensidad. (NOTA IMPORTANTE: La energía cinética por electrón no cambia si se modifica la intensidad, sólo cuando se manipula la frecuencia)
- Aunque cada metal tiene su propia frecuencia umbral única, todos tienen patrones similares.