Mając do czynienia z izotopami pierwiastka, należy pamiętać, że są one odróżniane od siebie poprzez dodanie liczby masowej do nazwy pierwiastka.
W twoim przypadku, nazwa bor-11 jest używana do oznaczenia izotopu boru, który ma liczbę masową równą #11#.
Ponieważ liczbę masową definiuje się jako sumę liczby protonów i liczby neutronów, które atom ma w swoim jądrze, wynika z tego, że można napisać
#color(blue)(A = Z + „no. neutronów”)””#, gdzie
#A# – liczba masowa
#Z# – liczba atomowa
Jak wiadomo, o tożsamości pierwiastka decyduje wyłącznie liczba protonów, jaką ma on w swoim jądrze. Liczba ta stanowi liczbę atomową pierwiastka.
A więc, aby zidentyfikować liczbę atomową boru, spójrz szybko na układ okresowy. Zauważ, że bor, #”B „#, który znajduje się w okresie 2, grupie 13 układu okresowego, ma liczbę atomową równą #5#.
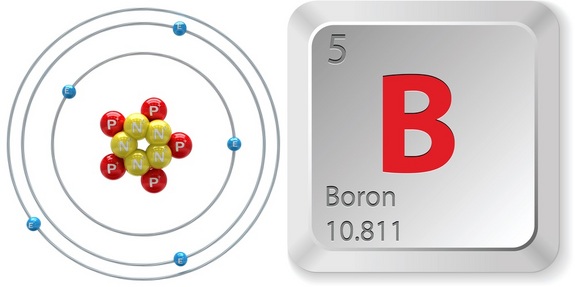
To oznacza, że każdy atom, który ma #5# protonów w swoim jądrze będzie atomem boru.
Więc, liczba masowa tego izotopu boru jest równa #11#, a liczba atomowa #5#.