Raport przypadku
Management of Proliferative Endometrium on Biopsy in Post-Menopausal Women
Sidharth Srinivas1, Sachchidananda Maiti2, Perunkulam Jothilakshmi2
1Manchester Medical School, University of Manchester, Manchester, United Kingdom
2Obstetrics & Gynaecology, The Pennine Acute NHS Hospitals, Crumpsall, United Kingdom
Adres e-mail:
 (S. Srinivas)
(S. Srinivas) Aby zacytować ten artykuł:
Sidharth Srinivas, Sachchidananda Maiti, Perunkulam Jothilakshmi. Management of Proliferative Endometrium on Biopsy in Post-Menopausal Women. Journal of Gynecology and Obstetrics. Vol. 4, No. 6, 2016, pp. 38-43. doi: 10.11648/j.jgo.20160406.12
Received: 4 września, 2016; Zaakceptowano: 21 września 2016 r.; Opublikowano: October 15, 2016
Abstract: Post-menopausal bleeding (PMB) is usually caused by several endometrial conditions (hyperplasia and carcinoma) for which there are evidence-based treatments. Niewiele jest jednak literatury na temat leczenia rozrostu endometrium bez atypii w biopsji endometrium metodą Pipelle u kobiet zgłaszających się z PMB. Naszym celem jest zbadanie możliwości postępowania i leczenia u tej podgrupy kobiet. Jest to retrospektywny, obserwacyjny przegląd serii przypadków kobiet zgłaszających się z PMB do kliniki ginekologicznej szybkiego dostępu w District General Hospital w Manchesterze, w Wielkiej Brytanii, w okresie trzech tygodni. Wybrano cztery kobiety, u których stwierdzono proliferacyjne lub wydzielnicze endometrium podczas biopsji endometrium Pipelle. Następnie przeanalizowano ich historię, wyniki badania, badania, leczenie i wyniki badań kontrolnych. Ta seria przypadków pozwoliła zidentyfikować dylematy związane z postępowaniem u pacjentek z rozrostem endometrium bez atypii podczas pobierania próbek endometrium. Cztery pacjentki poddano obserwacji, wykonując powtórną biopsję endometrium metodą Pipelle’a sześć tygodni po zgłoszeniu się na specjalistyczny oddział ginekologiczny. Następnie udzielono im porady lub zastosowano doustną terapię progesteronem przez sześć do ośmiu tygodni. Opcje postępowania obejmowały system wewnątrzmaciczny Mirena (IUS), doustną terapię progesteronem i wypisanie pacjentki z powrotem do podstawowej opieki zdrowotnej. Nie ma zgody co do znaczenia doustnego progesteronu lub czasu trwania obserwacji koniecznej do monitorowania rozwoju hiperplazji endometrium lub raka w tej podgrupie pacjentek. Konieczne są dalsze badania w celu opracowania opartych na dowodach naukowych wytycznych postępowania w przypadku endometrium proliferacyjnego u kobiet z PMB.
Słowa kluczowe: Post-Menopausal Bleeding, Proliferative Endometrium Without Atypia, Progesterone Therapy
1. Wprowadzenie
Krwawienie po menopauzie jest ważnym i częstym objawem w klinice ginekologii. Konieczne jest pilne przeprowadzenie badań w celu wykluczenia raka endometrium – najczęstszego ginekologicznego nowotworu złośliwego w Wielkiej Brytanii. Łagodne przyczyny, takie jak zanikowe zapalenie pochwy, polipy i włókniaki również mogą powodować znaczny stres u pacjentki. Histologiczna diagnoza hiperplazji endometrium zwiększa ryzyko złośliwości i wymagane jest leczenie w celu wywołania regresji. W przeciwieństwie do tego, rozpoznanie histologiczne rozrostu endometrium bez komórek atypowych pozostawia klinicystów bez leczenia opartego na dowodach i niepewności co do potencjału transformacji złośliwej.
W niniejszym raporcie przeanalizowaliśmy cztery przypadki PMB, u których w badaniu histologicznym stwierdzono rozrost endometrium. Ta seria przypadków jest interesująca, ponieważ w literaturze brakuje dowodów na istnienie endometrium proliferacyjnego u kobiet po menopauzie z objawami PMB, a w konsekwencji brak jest leczenia opartego na dowodach. Niniejsze doniesienie pozwoli zidentyfikować obszary niepewności w naszym rozumieniu i postępowaniu z tymi pacjentkami.
Metody
Jest to retrospektywna, obserwacyjna seria przypadków obejmująca kobiety zgłaszające się z objawem PMB do ginekologicznej kliniki szybkiego dostępu (RAC) w District General Hospital w Manchesterze w okresie 3 tygodni w listopadzie 2014 roku. Cztery pacjentki, u których stwierdzono proliferacyjne lub wydzielnicze endometrium podczas pobierania próbek endometrium za pomocą urządzenia Pipelle, zostały wybrane losowo. Wszystkie kobiety po menopauzie w tej serii przypadków zostały skierowane w trybie pilnym do opieki wtórnej po wystąpieniu co najmniej jednego epizodu krwawienia. Do tej serii przypadków włączono kobiety w każdym wieku, które przeszły naturalną menopauzę. Opisy przypadków wykorzystano do analizy historii choroby, wyników badań, badań, leczenia i dalszej obserwacji każdego pacjenta.
2. Seria przypadków
Tabela 1. Istotne aspekty wywiadu z pacjentem.
| Pacjent | Wiek &Stan menopauzalny | Powód skierowania | Objawy towarzyszące | Przeszłość medyczna | Koncepcja, HRT & Status tamoksyfenu | Historia wymazu z szyjki macicy |
| 1 | 54, pomenopauzie od 2 lat | Dwa obfite krwawienia przez pięć dni każde | Dyskomfort brzuszny dyskomfort | Nil | Nil | Normal & do-do dnia dzisiejszego |
| 2 | 59, po menopauzie od 5 lat | Trzynastodniowe obfite krwawienie z pochwy ze skrzepami | Dyskomfort w podbrzuszu i utrata masy ciała | Cukrzyca typu 2, nadciśnienie tętnicze i kamica żółciowa | GP rozpoczął leczenie Norethisteronem w związku z krwawieniem | Normalny &dotychczasowy-do dnia dzisiejszego |
| 3 | 52, po menopauzie 1 rok | Irregularnie grube endometrium w badaniu USG w podstawowej opiece zdrowotnej | Przerywane krwawienia ze skrzepami i zalaniami | Rak piersi, Dwustronna mastektomia i usunięcie węzłów pachowych | Mirena IUS i Tamoxifen jeden rok temu | Normalny &dodo dnia dzisiejszego |
| 4 | 59, po menopauzie | Osiem dni ciągłego, lekkiego krwawienia z pochwy | Łagodny ból brzucha | Nadciśnienie tętnicze, nadczynność tarczycy, podwyższony wskaźnik masy ciała | Nie | Nieznany |
Tabela 2. Wyniki badań i leczenie.
| Pacjent | Badanie miednicy & TVUS | Histeroskopia | Biopsja pipelkowa | Powtórna pipelle biopsy | Treatment | Długość obserwacjiup |
| 1 | Normal & 1.3mm | Nie wykonuje się | Proliferacyjne endometrium bez atypii lub złośliwości | Secretory endometrium with no atypia or malignancy | MDPA 100mg BD przez 6 do 8 tygodni | 6 tygodni |
| 2 | Normal & 10mm | Normal oprócz 2.5mm polipa polipowatego | Sekretacyjne endometrium bez atypii i złośliwości | Proliferacyjne endometrium bez atypii lub złośliwości | Poradnictwo w zakresie stosowania Mirena IUS | 6 tygodni |
| 3 | Normal &2mm | Nie wykonano | Proliferative endometrium with no atypia or malignancy | Proliferative endometrium with no atypia or złośliwości | Nil | 8 tygodni |
| 4 | Normalny & 10mm | Normalny poza małym polipem | Proliferacyjne endometrium bez atypii i złośliwości | Proliferacyjne endometrium bez atypii i złośliwości | MDPA 100mg BD przez 6 do 8 tygodni | 8 tygodni |
3. Dyskusja
3.1. Zmiany w endometrium w okresie menopauzy
Zanik endometrium, które ulega atrofii i traci swoją warstwę funkcjonalną, ze zrębu endometrialnego, który staje się włóknisty i gruczołów, które nie wykazują aktywności proliferacyjnej ani wydzielniczej – to przyjęty obraz endometrium po menopauzie. Regresja endometrium zbiega się w czasie z ustaniem miesiączki, dlatego w przypadku krwawienia należy wykluczyć patologię. Fizjologia endometrium po menopauzie i jego rola w patologii miednicy mniejszej budzą zainteresowanie w ostatnich dekadach, ze szczególnym uwzględnieniem prekursorów raka endometrium. Jednakże, istnieje znacznie mniejsza ilość literatury na temat endometrium po menopauzie w porównaniu z endometrium w okresie reprodukcyjnym.
Wszystkie badania wykazały, że trzy czwarte kobiet po menopauzie ma zanikające endometrium z różnym stopniem rozszerzenia gruczołów torbielowatych. Kolejne 15% ma polipy endometrialne złożone z gruczołów torbielowatych. Endometrium wykazujące proliferację i hiperplazję stanowi pozostałe 10%. Zanik endometrium obserwuje się w pierwszym roku menopauzy, a częstość jego występowania utrzymuje się na stałym poziomie przez cały okres menopauzy. W przeciwieństwie do przypadków proliferacji i hiperplazji, które są widoczne głównie w ciągu pierwszych 5 lat po menopauzie.
W 1954 roku McBride przeanalizował endometrium po menopauzie w dużym badaniu; pobierając próbki za pomocą wyłyżeczkowania od 1521 pacjentek w różnych okresach po menopauzie. W 1315 próbkach uzyskano niewiele materiału poza śluzem, podczas gdy pozostałe 206 przypadków wykazało następujące wzorce endometrium: atrofia, pojedynczy lub rozproszony gruczoł torbielowaty, hiperplazja, proliferacja, polipy wydzielnicze i włóknisto-adenomatyczne. Uzyskane wyniki sugerują, że częstość występowania endometrium proliferacyjnego lub wydzielniczego wynosi 6,3%. Autor proponuje jednak, aby w przypadku braku próbki endometrium było nieaktywne lub uległo atrofii. Przy takim założeniu częstość występowania endometrium proliferacyjnego lub wydzielniczego wynosi 0,8%. To prowadzi nas do przekonania, że prawdziwa częstość występowania endometrium proliferacyjnego lub sekrecyjnego leży pomiędzy 6.3% a 0.9% .
Badanie biopsji endometrium od kobiet w okresie około- i pomenopauzalnym, stosujących HRT, wykazało, że większość endometrium jest atroficzna (68.7%) lub proliferacyjna (23.5%). Podczas gdy 0,6% wykazywało prostą hiperplazję bez atypii, 0,5% miało wydzielnicze endometrium, a dobrze zróżnicowany gruczolakorak występował w 0,07% przypadków. Sugeruje to, że kobiety po menopauzie otrzymujące stymulację hormonalną mają większą częstość występowania endometrium proliferacyjnego.
3.2. Przyczyny krwawienia po menopauzie
Krwawienie po menopauzie odnosi się do każdego krwawienia z pochwy u kobiety po menopauzie, które nie jest spodziewanym cyklicznym krwawieniem występującym przy sekwencyjnej hormonalnej terapii zastępczej. PMB uzasadnia pilne skierowanie do ginekologa, ponieważ 10% tych pacjentek ma raka endometrium. Wczesne rozpoznanie raka endometrium jest ważne dla zmniejszenia miejscowego i złośliwego rozprzestrzeniania się i wiąże się z przeżyciem do 90%. Rak endometrium często występuje wcześnie z PMB, jednak zanikowe zapalenie pochwy i łagodne zmiany, takie jak polipy i włókniaki są powszechne. W jednym z badań stwierdzono, że do 30% przypadków PMB ujawnia anatomiczne nieprawidłowości leżące u podstaw tego schorzenia (patrz tabela 3).
Tabela 3. Anatomiczne przyczyny krwawień po menopauzie.
| Endometrium | Szyjka macicy | Pochwa | Jajnik | |
| Włókniaki | Polipy | Stroficzne zapalenie pochwy | Rak | |
| Hiperplazja | Rak | Rak | ||
| Polipy | ||||
| Rak | ||||
| Endometritis |
3.3. Investigation of Post-Menopausal Bleeding
Zgodnie z wytycznymi National Institute of Clinical Excellence (NICE) trzy pacjentki z naszej serii przypadków prezentujących PMB, a nie na HRT, wszystkie zostały skierowane do opieki wtórnej w celu wykluczenia raka . Wszystkie te pacjentki były widziane w ciągu 2 tygodni w klinice ginekologii – spełniając krajowy cel dla pilnych skierowań.
Pacjentki leczone HRT są bardziej złożone, ponieważ może być trudno odróżnić normalne krwawienie cykliczne od nieregularnego. Krwawienie z macicy lub plamienie przy rozpoczęciu stosowania HRT jest powszechne, ale powinno ustąpić po 6 miesiącach. NICE zaleca jednak pilne skierowanie na badanie w przypadku uporczywych lub niewyjaśnionych krwawień pomenopauzalnych po zaprzestaniu stosowania HRT przez 6 tygodni.
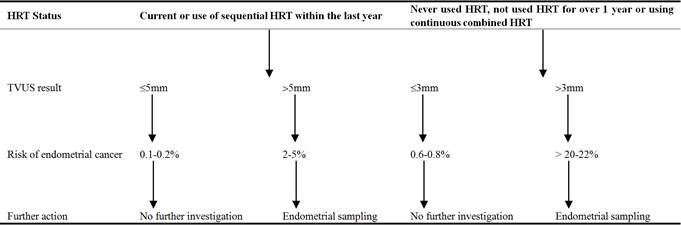
The Scottish Intercollegiate Guidelines Network (SIGN) oferuje algorytm postępowania w przypadku PMB (patrz tabela 4). Zgodnie z tymi wytycznymi wszystkie cztery pacjentki poddano badaniu miednicy w celu poszukiwania łagodnych przyczyn krwawienia, takich jak ektropion szyjki macicy, polipy lub w celu wysunięcia podejrzenia nowotworu złośliwego. Cenny jest dokładny wywiad z identyfikacją czynników ryzyka raka endometrium, takich jak historia przewlekłej anowulacji, otyłość, cukrzyca, stosowanie estrogenów lub tamoksyfenu oraz zespoły genetyczne. Ponadto, badanie przez wziernik pozwala doświadczonym klinicystom na rozpoznanie zmian w obrębie sromu, pochwy i szyjki macicy. Dokładny wywiad i badanie mogą również wzbudzić podejrzenie rzadkich przyczyn krwawienia z pochwy, takich jak zaburzenia krzepnięcia i białaczka.
Zgodnie z zaleceniami SIGN, TVUS było badaniem pierwszego rzutu u kobiet zgłaszających się z PMB w naszej serii przypadków. Jego baza dowodowa, wygoda i brak powikłań czynią go idealnym badaniem do oceny pacjentek z podwyższonym ryzykiem raka. Z grubszym endometrium, ryzyko patologii, takich jak złośliwość, wzrasta, co uzasadnia dalsze badania. Podczas gdy kobiety z cienkim endometrium mogą być uspokojone i ponownie wezwane do dalszych badań tylko wtedy, gdy krwawienie utrzymuje się. Ustalenie wartości odcięcia dla grubości endometrium równoważy potrzebę identyfikacji wszystkich złośliwych patologii przy jednoczesnym minimalizowaniu nadmiernego wykorzystania zasobów. Ustalenie wartości odcięcia na poziomie 3 mm zapewnia wysoką czułość (100%), ale obniża specyficzność (25,8%) badania, co skutkuje nadmierną liczbą badanych pacjentek. Obecnie w praktyce klinicznej stosuje się 4 mm, ponieważ uważa się, że oferuje ona optymalną czułość (91,6%) i swoistość (44,5%) .
Dostępne są inne formy ultrasonografii, takie jak doppler przezpochwowy, trójwymiarowa, wzmocniona solą fizjologiczną oraz pomiar tekstury endometrium i analiza marginesów. Jednakże badania nie wykazały ich przewagi nad TVUS i nie są one obecnie zalecane ani stosowane w rutynowej praktyce klinicznej
Bezpośrednia inspekcja i pobieranie próbek tkanki endometrialnej jest uważane za złoty standard i drugą linię badań w tej kohorcie pacjentek. Aktualna praktyka i wytyczne SIGN zalecają stosowanie urządzeń do biopsji endometrium w celu dalszego badania pacjentek, u których ryzyko zachorowania na raka endometrium jest wyższe. Konwencjonalnie do badania nieprawidłowego krwawienia stosowano łyżeczkowanie, ale obecnie dowody przemawiają za stosowaniem urządzeń do pobierania próbek endometrium, takich jak urządzenie Pipelle – stosowane u wszystkich czterech pacjentek w mojej serii przypadków. Urządzenie to ma wskaźnik wykrywalności 99,6% dla raka endometrium u kobiet po menopauzie, jak również wysoką czułość (81%) i specyficzność (98%) dla identyfikacji atypowej hiperplazji. Podsumowując, połączenie TVUS i biopsji endometrium metodą Pipelle’a oferuje wystarczającą ilość informacji diagnostycznych, aby zdiagnozować lub wykluczyć łagodną i złośliwą chorobę endometrium.
Pacjentki leczone tamoksyfenem mają trzy do sześciu razy większą częstość występowania raka endometrium, a pilne skierowanie dla takich kobiet skarżących się na PMB jest zalecane przez NICE. Wykazano, że ryzyko raka i proliferacji, ze względu na słabe działanie estrogenne tamoksyfenu, wzrasta wraz z rosnącą dawką i czasem trwania leczenia. Pacjentka 3 z naszej serii przypadków, 59-letnia kobieta przyjmująca tamoksyfen, była bardziej szczegółowo badana za pomocą histeroskopii, oprócz TVUS i biopsji Pipelle. Jest to zgodne z wytycznymi, które sugerują, że histeroskopia z biopsją jest preferowana w stosunku do TVUS, ponieważ interpretacja ultrasonografii jest utrudniona przez pogrubienie endometrium u pacjentek przyjmujących tamoksyfen.
Tabela 4. Kobiety z krwawieniem po menopauzie (nie przyjmujące tamoksyfenu).
3.4. Hiperplazja endometrium
Diagnoza hiperplazji endometrium (EH) stawiana jest u około 10% kobiet zgłaszających się z PMB. Światowa Organizacja Zdrowia (WHO) klasyfikuje hiperplazję endometrium jako typ prosty i złożony; każdy typ jest następnie dalej klasyfikowany na podstawie obecności lub braku atypii jądrowej. Kobiety, u których stwierdzono atypię (patrz rysunek 2) w biopsji endometrium, wymagają dalszych badań, ponieważ u około 50% z nich współistnieje rak endometrium. Ponadto, ryzyko progresji do raka jest zwiększone w obecności atypii (27,5% w 9 lat po diagnozie), ale znacznie niższe w przypadku hiperplazji bez atypii (4,6% w 9 lat po diagnozie). Biorąc pod uwagę prawdopodobieństwo wystąpienia w przyszłości nowotworu złośliwego, u kobiet po menopauzie z EH z obecnością atypii zaleca się histerektomię z obustronną salpingo-oforektomią. W przypadku braku komórek atypowych, kobiety mogą być leczone progestynami i wykonywać seryjne biopsje co 6 miesięcy, aby zapewnić odpowiedź na leczenie. Powszechnie stosowane progestyny to octan megestrolu i octan medroksyprogesteronu. Chociaż cztery pacjentki w naszej serii przypadków nie mają hiperplazji endometrium, można postulować, że gdyby znaleziono komórki atypowe, ryzyko złośliwości i potrzeba dalszych badań wzrosłyby u pacjentek z proliferacyjnym lub wydzielniczym endometrium.
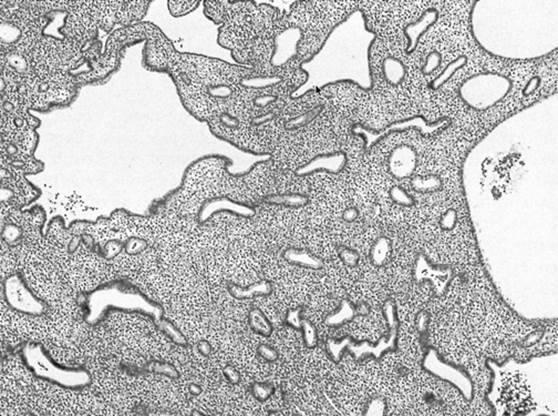
Rycina 1. Biopsja endometrium ukazująca prostą hiperplazję endometrium, z gruczołami endometrialnymi rozmieszczonymi nieregularnie i szeroko rozdzielonymi przez hiperplastyczny zrąb .
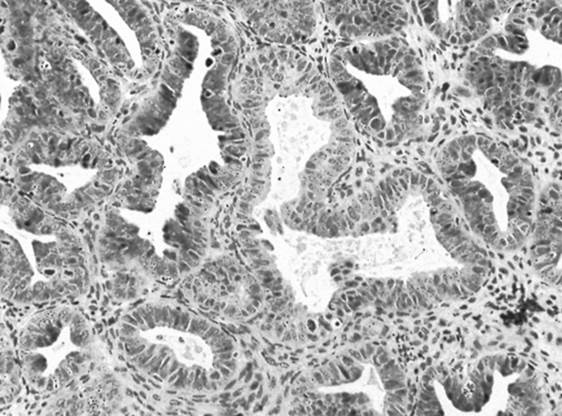
Rycina 2. Biopsja endometrium ukazująca hiperplazję endometrium z atypowymi komórkami gruczołowymi .
3.5. Patogeneza endometrium proliferacyjnego
Mój raport zidentyfikował kobiety po menopauzie, których biopsje naśladowały endometrium znalezione w miesięcznym cyklu menstruacyjnym kobiety reprodukcyjnej. Zwiększona aktywność mitotyczna nabłonka zrębu z towarzyszącą hiperplazją komórek i zwiększoną macierzą zewnątrzkomórkową skutkuje pogrubieniem endometrium podczas fazy proliferacyjnej endometrium (patrz rysunek 3). Proliferacja ta jest stymulowana przez estrogeny wydzielane przez rozwijające się w cyklu miesiączkowym pęcherzyki jajnikowe. Progesteron przeciwstawia się działaniu estrogenów i swoim działaniem hamuje fazę proliferacyjną cyklu endometrialnego. Progesteron indukuje fazę wydzielniczą poprzez stymulację gruczołów endometrialnych i zwiększenie unaczynienia (patrz ryc. 4). Grubość endometrium zwiększa się wraz z powiększaniem się gruczołów, komórek zrębu i naczyń krwionośnych. Uważa się, że u kobiet po menopauzie niski poziom estrogenów i progesteronu z pozapęcherzykowych źródeł stymuluje endometrium do proliferacji. Ponadto, fitoestrogeny takie jak nasiona oleiste, produkty sojowe i tofu są substancjami roślinnymi, które strukturalnie i funkcjonalnie są podobne do estradiolu. Pomimo badań sugerujących, że fitoestrogeny nie indukują proliferacji ani nie zwiększają ryzyka raka endometrium, ich długoterminowe efekty są stosunkowo nieznane. Podobnie, nie ma pewności co do stosowania bez recepty black cohosh – leku ziołowego o potencjalnym działaniu proliferacyjnym na endometrium.
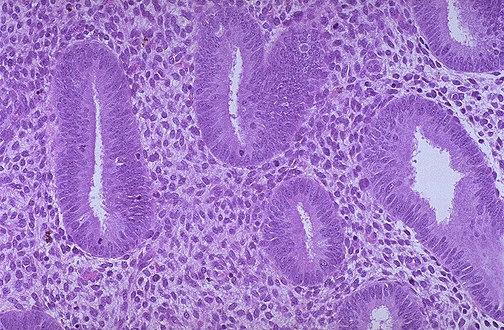
Rysunek 3. Mikroskopowy wygląd endometrium proliferacyjnego, z proliferacją gruczołów cewkowych i gęstym zrębu .
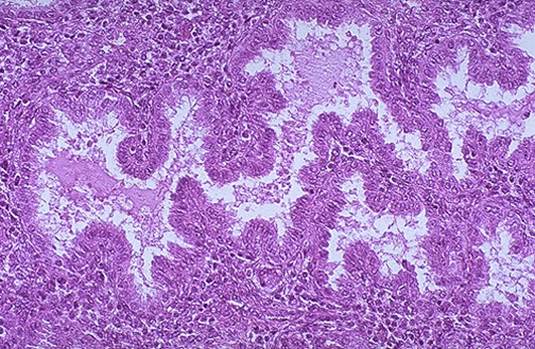
Rysunek 4. Mikroskopowy wygląd endometrium wydzielniczego i duże, krętowate gruczoły wypełnione wydzielinami .
Badania wykazały, że endometrium proliferacyjne nie jest rzadkością, a także sugerują, że nowotwory endometrium wywodzą się z tła aktywności proliferacyjnej, a nie inercji . Prawdopodobieństwo przekształcenia się prostego endometrium proliferacyjnego w nowotwór złośliwy jest jednak bardzo niskie i znacznie niższe niż 0,3 do 1% ryzyka progresji hiperplazji endometrium do raka. Jednakże, czynniki ryzyka obejmują zwiększony wskaźnik masy ciała i wiek. Oba te czynniki są związane z obwodową aromatyzacją i częstymi chorobami współistniejącymi u pacjentek z rakiem endometrium.
3.6. Postępowanie w przypadku rozrostu endometrium
Na podstawie naszej wiedzy nie ma opublikowanych badań dotyczących postępowania w przypadku rozrostu endometrium bez atypii w krwawieniu po menopauzie. W związku z tym, nie ma obecnie opartego na dowodach leczenia takich kobiet. Nie ma również konsensusu co do zalecanej dawki i czasu trwania leczenia MDPA w tej podgrupie pacjentek. Co więcej, nie ma zgody co do częstości obserwacji wymaganej w celu wykluczenia bardziej złowrogich patologii rozrostu endometrium.
Wśród ginekologów istnieje kilka szkół myślenia o tym, jak najlepiej postępować z tymi pacjentkami. Ponieważ zakłada się, że ryzyko przekształcenia się endometrium w raka jest bardzo małe, jedną z opcji jest uspokojenie pacjentki przed wypisaniem jej z powrotem do podstawowej opieki zdrowotnej. Z drugiej strony, bardziej konserwatywne podejście polega na zastosowaniu ogólnoustrojowej terapii progesteronowej w celu wywołania regresji endometrium. Doustny octan medroksyprogesteronu może być przepisywany na stosunkowo krótki okres (sześć do ośmiu tygodni w naszej serii przypadków) w celu wywołania regresji endometrium. Korzyści płynące z terapii progesteronem muszą być starannie zbilansowane z jej działaniami niepożądanymi, takimi jak ryzyko zakrzepicy żył głębokich. Bardziej długoterminową opcją rozważaną przez niektórych ginekologów jest system wewnątrzmaciczny Mirena, długo działająca odwracalna forma antykoncepcji, która rozrzedza endometrium poprzez uwalnianie progesteronu do macicy. Obie te formy progesteronu są również stosowane w hiperplazji endometrium i wykazano, że chronią endometrium przed proliferacją i złośliwą transformacją. Mirena IUS jest licencjonowana do zapewnienia ochrony endometrium przez 4 lata. U drugiej pacjentki z naszej serii przypadków rozpoczęto terapię progesteronem po tym, jak w jednej biopsji Pipelle wykryto proliferacyjne endometrium, podczas gdy u czwartej pacjentki rozpoczęto to samo leczenie po potwierdzeniu histopatologicznym za pomocą powtórnej biopsji Pipelle. W wyniku braku dowodów nie ma pewności, czy powtórna biopsja jest wymagana do potwierdzenia wyników, czy też pojedyncza biopsja jest wystarczająca do leczenia. Stwierdziliśmy również, że pacjentki w naszej serii przypadków były leczone doustnym medroksyprogesteronem przez 6 do 8 tygodni, ale żadne badanie, o którym wiemy, nie dotyczyło idealnego czasu trwania leczenia. Bardziej radykalnym podejściem do leczenia proliferacyjnego endometrium byłaby histerektomia w przypadku powtarzających się epizodów PMB, aby wyeliminować ryzyko transformacji w raka endometrium. Jednak ze względu na ryzyko anestezjologiczne, operacyjne i psychologiczne jest to rozwiązanie ostateczne. U trzech z czterech pacjentek za 6 tygodni wykonano powtórną biopsję endometrium metodą Pipelle. Nie ma jednak dowodów na to, jak częste powinny być badania kontrolne lub ocena odpowiedzi na leczenie. Ponadto nie jest jasne, czy czynniki ryzyka, takie jak wysokie BMI i rak piersi, powinny obniżać próg dla zaoferowania powtórnej biopsji Pipelle.
4. Wnioski
W niniejszym raporcie zidentyfikowano aktualne trendy w leczeniu rozrostowego endometrium za pomocą doustnego medroksyprogesteronu. Zwrócono uwagę na wiele obszarów niepewności, takich jak czas trwania leczenia i obserwacja. Konieczne są dalsze badania nad endometrium proliferacyjnym w PMB w celu opracowania wytycznych leczenia opartych na dowodach.
- UK CR. Cancer Statistics: Registrations Series. 2011.
- McBride. The normal post-menopausal endometrium. J Obstet Gynaecol Br Emp 1954;61 (5):691-7.
- Noer T. The histology of the senile endometrium. Acta Pathologica Microbiologica Scandinavica 1961;51 (3):193.
- Korhonen MO, Symons JP, Hyde BM, Rowan JP, Wilborn WH. Histologic classification and pathologic findings for endometrial biopsy specimens obtained from 2964 perimenopausal and postmenopausal women undergoing screening for continuous hormones as replacement therapy (CHART 2 Study). American Journal of Obstetrics and Gynecology 1997;176 (2):377.
- Goldstein RB, Bree RL, Benson CB, Benacerraf BR, Bloss JD, Carlos R, et al. Evaluation of the woman with postmenopausal bleeding: Society of Radiologists in Ultrasound-Sponsored Consensus Conference statement. J Ultrasound Med 2001;20 (10):1025-36.
- SIGN. Investigation of Post-Menopausal Bleeding. 2002.
- Paley PJ. Screening for the major malignancies affecting women: Aktualne wytyczne. American journal of obstetrics and gynecology 2001;184 (5):1021.
- NICECG27. Referral Guidlines for Suspected Cancer. 2005.
- Nand SL, Webster MA, Baber R, O’Connor V. Bleeding pattern and endometrial changes during continuous combined hormone replacement therapy. The Ogen/Provera Study Group. Obstet Gynecol 1998;91 (5 Pt 1):678-84.
- Davidson KG, Dubinsky TJ. Ultrasonographic evaluation of the endometrium in postmenopausal vaginal bleeding. Radiol Clin North Am 2003;41 (4):769-80.
- Gupta JK, Chien PFW, Voit D, Clark TJ, Khan KS. Ultrasonographic endometrial thickness for diagnosing endometrial pathology in women with postmenopausal bleeding: a meta-analysis. Acta Obstetricia et Gynecologica Scandinavica 2002;81 (9):799.
- Dijkhuizen FPHLJ, BrĂ-Lmann HAM, Potters AE, Bongers MY, Heintz APM. The Accuracy of Transvaginal Ultrasonography in the Diagnosis of Endometrial Abnormalities. Obstetrics & Gynecology 1996;87 (3):345-349.
- Ciatto S, Cecchini S, Gervasi G, Landini A, Zappa M, Crocetti E. Surveillance for endometrial cancer with transvaginal ultrasonography of breast cancer patients under tamoxifen treatment. Br J Cancer 2003;88 (8):1175-9.
- Weber G, Mere E, Bahlmanw E, Riisch B. Evaluation of different transvaginal sonographic diagnostic parameters in women with postmenopausal bleeding. Ultrasound in Obstetrics and Gynecology 1998;12 (4):265.
- Gruboeck K, Jurkovic D, Lawton F, Savvas M, Tailor A, Campbell S. The diagnostic value of endometrial thickness and volume measurements by three-dimensional ultrasound in patients with postmenopausal bleeding. Ultrasound in Obstetrics and Gynecology 1996;8 (4):272.
- Dijkhuizen FPHLJ, Mol BWJ, Brölmann HAM, Heintz APM. The accuracy of endometrial sampling in the diagnosis of patients with endometrial carcinoma and hyperplasia. Cancer 2000;89 (8):1765.
- Van den Bosch T, Vandendael A, Van Schoubroeck D, Wranz PA, Lombard CJ. Combining vaginal ultrasonography and office endometrial sampling in the diagnosis of endometrial disease in postmenopausal women. Obstet Gynecol 1995;85 (3):349-52.
- Curtis RE, Boice JD, Shriner DA, Hankey BF, Fraumeni JF. Second Cancers After Adjuvant Tamoxifen Therapy for Breast Cancer. Journal of the National Cancer Institute 1996;88 (12):832-835.
- Karlsson B, Granberg S, Wikland M, Torvid K, Marsal K, et al. Transvaginal ultrasonography of the endometrium in women with postmenopausal bleeding âa Nordic multicenter study. American Journal of Obstetrics and Gynecology 1995;172 (5):1488.
- Lacey JV, Chia VM. Endometrial hyperplasia and the risk of progression to carcinoma. Maturitas 2009;63 (1):39.
- Lacey JV, Sherman ME, Rush BB, Ronnett BM, Ioffe OB, Duggan MiA, et al. Absolute Risk of Endometrial Carcinoma During 20-Year Follow-Up Among Women With Endometrial Hyperplasia. Journal of Clinical Oncology 2010;28 (5):788-792.
- Silverberg. Tumors of the Uterine Corpus and Gestational Trophoblastic Disease. AFIP Atlas of Tumor Pathology 1995.
- Balk JL, Whiteside DA, Naus G, DeFerrari E, Roberts JM. A pilot study of the effects of phytoestrogen supplementation on postmenopausal endometrium. J Soc Gynecol Investig 2002;9 (4):238-42.
- Patologia FG. http://library.med.utah.edu/WebPath/FEMHTML/FEMIDX.html#2.
- Sivridis E, Giatromanolaki A. Proliferative activity in postmenopausal endometrium: the lurking potential for giving rise to an endometrial adenocarcinoma. J Clin Pathol 2004;57 (8):840-4.
- Baak JP, Wisse-Brekelmans EC, Fleege JC, van der Putten HW, Bezemer PD. Assessment of the risk on endometrial cancer in hyperplasia, by means of morphological and morphometrical features. Pathol Res Pract 1992;188 (7):856-9.
- Wan YL, Holland C. The efficacy of levonorgestrel intrauterine systems for endometrial protection: a systematic review. Climacteric; 14 (6):622-632.
.