Pravin U. Dugel, MD
Phoenix
Pseudofakijny torbielowaty obrzęk plamki został po raz pierwszy opisany przez A. Ray Irvine Jr, MD,1 w 1953 r., a następnie wyjaśniony przez J. Donalda M Gassa, MD, w 1969 r.2 Dr Gass opisał, że szczyt zachorowalności przypadał na sześć tygodni po operacji, i zasugerował, że istnieje różnica między angiograficznym a klinicznie istotnym PCME, ponieważ tylko kilku pacjentów skarżyło się na pogorszenie widzenia. Kliniczne PCME jest obecnie definiowane jako ostrość wzroku w skali Snellena 20/40 lub gorsza. Powszechne objawy obejmują obniżenie ostrości wzroku i wrażliwości na kontrast, a także metamorfopsję.
Ale przyjęcie fakoemulsyfikacji zamiast zewnątrztorebkowego usunięcia zaćmy zmniejszyło częstość występowania PCME z zakresu 16 do 24%,3 coraz częstsze stosowanie wieloogniskowych implantów soczewek wewnątrzgałkowych doprowadziło do zwiększenia oczekiwań pacjentów. Ze względu na konstrukcję tych nowych implantów, które z natury zmniejszają wrażliwość na kontrast, nawet łagodny PCME może powodować znaczne obniżenie jakości widzenia i satysfakcji pacjenta. Agencja ds. Żywności i Leków (Food and Drug Administration) aprobując zastosowanie każdej nowej IOL stwierdza, że „akceptowalny odsetek” klinicznie istotnych PCME powinien być mniejszy niż 5 procent. Biorąc pod uwagę szybko rozwijającą się technologię chirurgiczną i IOL, „klinicznie istotne” PCME może wymagać przedefiniowania, aby dopasować się zarówno do wymagań wizualnych pacjenta, jak i jego oczekiwań.
Zachorowalność
Zachorowalność na PCME po fakoemulsyfikacji u niepowikłanych pacjentów z grupy niskiego ryzyka może wahać się od 2% do 12%.4,5 Uważa się, że szczyt zachorowalności występuje sześć tygodni po operacji.2 Czynniki predysponujące do rozwoju PCME w tej populacji obejmują historię okluzji żyły siatkówki, obecność błony epiretinalnej i przedoperacyjne stosowanie prostaglandyn.4 U pacjentów z cechami wysokiego ryzyka, takimi jak cukrzyca, lub w skomplikowanych przypadkach, częstość występowania może być znacznie wyższa. (Heier JS, et al. Characteristics of patients with CME following phacoemulsification. Przedstawione na dorocznym spotkaniu Amerykańskiej Akademii Okulistyki; listopad 2007; Nowy Orlean, LA.)
Mechanizm
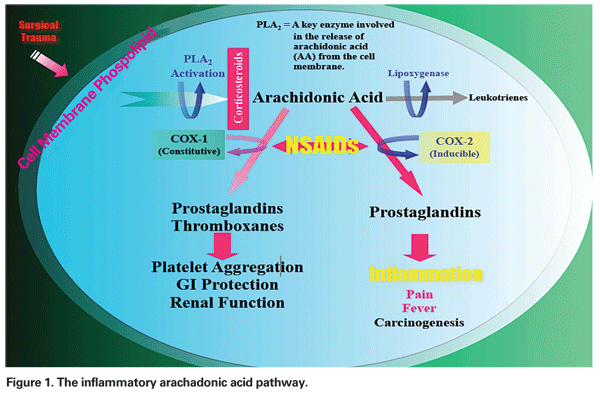
Mechanizm rozwoju PCME może być wieloczynnikowy, z różnym stopniem komponenty zapalnej i mechanicznej. Manipulacje chirurgiczne w obrębie przedniego odcinka oka powodują uwalnianie kwasu arachadonowego z błon komórkowych, co prowadzi do produkcji prostaglandyn i leukotrienów na drodze odpowiednio cyklo-oksygenazy (COX) i lipooksygenazy (LOX) (patrz Rycina 1). Te mediatory zapalne zwiększają wazoprzepuszczalność, prowadząc w ten sposób do rozwoju PCME.
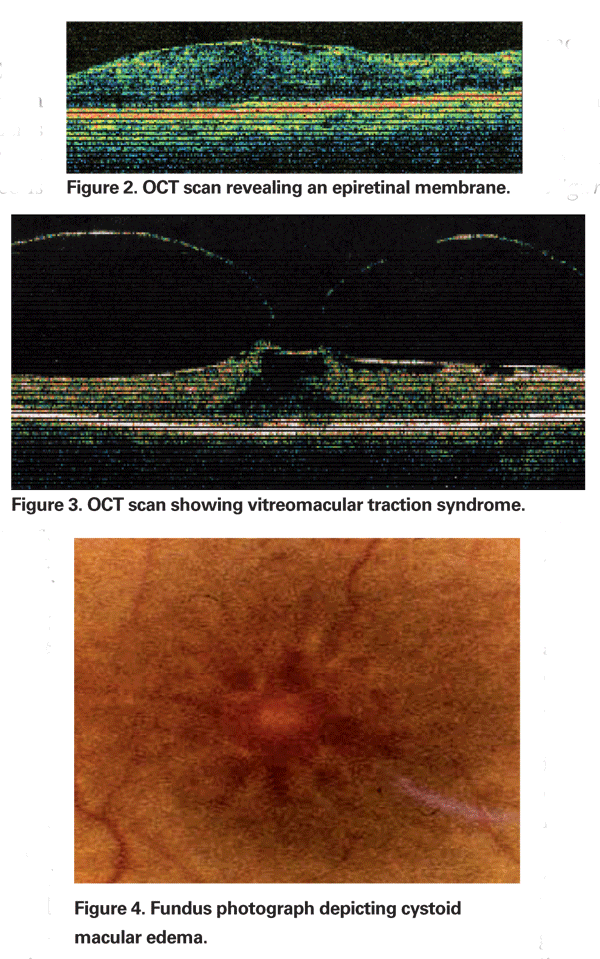
Okresowo, stan zapalny wywołany ekstrakcją zaćmy może powodować skurcz tylnej części ciała modzelowatego, prowadząc do zniekształcenia kapilar parafowalnych i w rezultacie do obrzęku plamki. Coraz częstsze stosowanie optycznej koherentnej tomografii stało się ważnym elementem oceny PCME. Obrazy OCT są pomocne w identyfikacji mechanicznego komponentu CME, w tym trakcji szklistkowo-macularnej lub błon epiretinalnych (patrz ryc. 2 & 3).
W rzadkich przypadkach przewlekłego, opornego na leczenie PCME u pacjentów niskiego ryzyka, bez żadnej innej możliwej do zidentyfikowania etiologii, oko musi być dokładnie zbadane pod kątem obecności zatrzymanych fragmentów soczewki, malpozycji IOL lub obecności infekcji Propionibacterium acnes.
Diagnostyka
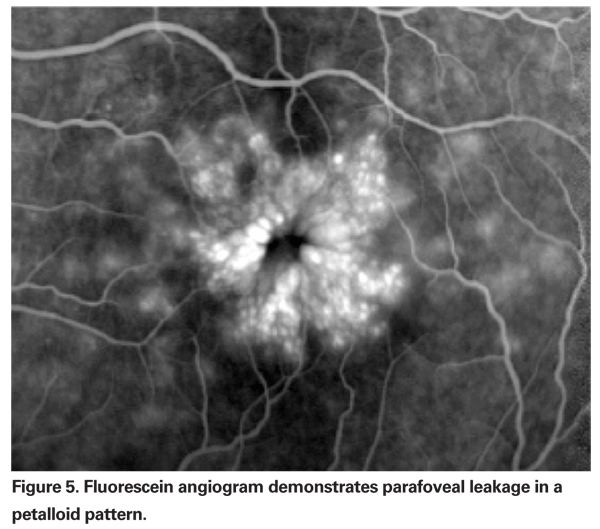
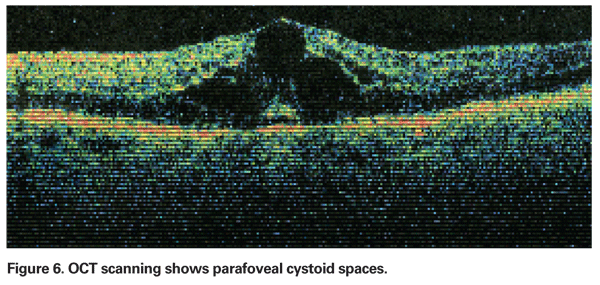
PCME należy podejrzewać, gdy pacjent bez współistniejących czynników ryzyka skarży się na pogorszenie widzenia lub metamorfopsję po usunięciu zaćmy. Klinicznie można zaobserwować wewnątrzsiatkówkowy obrzęk zawarty w przestrzeniach przypominających torbiele w układzie plastra miodu wokół fovea (patrz Rycina 4). Na angiogramie fluoresceinowym widoczny jest petaloidalny wzór przecieku do wewnątrzsiatkówkowych przestrzeni parafowkowych, wraz z hiperfluorescencją tarczy nerwu wzrokowego (patrz Rysunek 5). OCT może wyraźnie wykazać te cystoidalne przestrzenie, jak również obliczyć centralną grubość plamki i całkowitą objętość plamki (patrz rysunek 6). Zaletami OCT są wysoka czułość, nieinwazyjność, dostarczanie informacji anatomicznych oraz możliwość ilościowego określenia obrzęku plamki, chociaż istnieje wątpliwa korelacja tych wartości z funkcją wzroku.
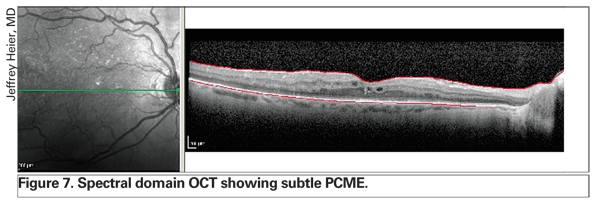
Zastosowanie OCT rewolucjonizuje zarządzanie obrzękiem siatkówki. Nowsze technologie, w tym OCT w dziedzinie spektralnej, zapewniają lepszą rozdzielczość i mogą wykryć subtelne PCME wcześniej niż biomikroskopia z lampą szczelinową i angiografia fluoresceinowa (patrz Rycina 7). Ponadto, to ulepszone oprzyrządowanie pozwala klinicyście na rozróżnienie pomiędzy wyłącznie wewnątrzsiatkówkowym obrzękiem a płynem podsiatkówkowym lub płynem w nabłonku podtorebkowym, co może dostarczyć informacji prognostycznych (patrz Rycina 8). Z doświadczenia kilku specjalistów zajmujących się siatkówką wynika, że obecność podtwardówkowego odwarstwienia nabłonka barwnikowego może zwiastować gorsze rokowanie.
Prewencja
Przeprowadzono kilka retrospektywnych przeglądów i prospektywnych badań oceniających wpływ profilaktycznego stosowania niesteroidowych leków przeciwzapalnych.steroidowych leków przeciwzapalnych na częstość występowania PCME, gdy są one stosowane przed operacją w porównaniu z leczeniem pooperacyjnym. W jednym z doniesień trzydniowa terapia wstępna trometaminą ketorolaku (Acular) była lepsza niż krople podawane na godzinę przed zabiegiem.6 W porównaniu z leczeniem samymi kortykosteroidami pooperacyjnymi, w innej grupie odnotowano zmniejszenie częstości PCME z 12% do 0% przy zastosowaniu dwóch dni przedoperacyjnego podawania diklofenaku sodowego (Voltaren) i kombinacji diklofenaku i kortykosteroidów pooperacyjnych.5
Używając OCT do ilościowego określenia objętości plamki, badacze stwierdzili, że dwa dni leczenia przedoperacyjnego ketorolakiem i pooperacyjna terapia skojarzona ketorolakiem/steroidem doprowadziły do 46-procentowego zmniejszenia obrzęku plamki miesiąc po operacji w porównaniu z grupą kontrolną otrzymującą wyłącznie steroidy.7 Ostatnio w randomizowanym badaniu prospektywnym porównującym trzy dni przedoperacyjnej ketorolaku i terapii skojarzonej z samym kortykosteroidem odnotowano, że na podstawie OCT u pacjentów z grupy kontrolnej częstość występowania PCME wynosiła 2,4% w porównaniu z 0% w kohorcie stosującej terapię skojarzoną.8 Chociaż pacjenci w grupie kortykosteroidów mieli istotnie większą częstość występowania pogrubienia siatkówki ≥15 µm, nie było statystycznej różnicy w najlepszej skorygowanej ostrości wzroku między obiema grupami cztery tygodnie po zabiegu.
W prospektywnej ocenie trzech grup przydzielonych do miejscowej indometacyny przez trzy dni przed operacją, a następnie terapii skojarzonej, pooperacyjnej terapii skojarzonej lub tylko kortykosteroidu, częstość występowania angiograficznego PCME została zmniejszona z 32.8 procent (tylko kortykosteroid) do 15 procent (pooperacyjne leczenie skojarzone) do 0 procent (przed- i pooperacyjne NLPZ).9
W innym doniesieniu stwierdzono, że dodanie soli sodowej nepafenaku (Nevanac) do pooperacyjnego schematu kortykosteroidowego zmniejszyło częstość występowania PCME z 2,1 procent do 0 procent w porównaniu z samym kortykosteroidem.10 W niedawno przeprowadzonym prospektywnym randomizowanym porównaniu samego diklofenaku z betametazonem po operacji stwierdzono, że w pięć tygodni po zabiegu częstość występowania angiograficznego CME była mniejsza w grupie NLPZ (18,8%) niż w grupie kortykosteroidów (58,0%).11
Badania te pokazują, że profilaktyczne stosowanie NLPZ zmniejsza częstość występowania PCME, a ich skuteczność jest największa, gdy ich stosowanie rozpoczyna się co najmniej trzy dni przedoperacyjnie i kontynuuje pooperacyjnie przez kilka tygodni. Jednak dokładny czas i okres trwania leczenia przed- i pooperacyjnego oraz identyfikacja chorych, którzy odnieśliby największe korzyści, pozostają nadal nieokreślone.
Charakterystyka wysokiego ryzyka
Jak wspomniano wcześniej, w serii 1,659 kolejnych przypadków, błona nasiatkówkowa, okluzja żyły w wywiadzie lub przedoperacyjne stosowanie analogów prostaglandyn znacznie zwiększały ryzyko rozwoju PCME.4 Analizując serię kolejnych pacjentów kierowanych do kliniki chorób siatkówki w celu leczenia PCME, inna grupa stwierdziła, że cechami wysokiego ryzyka są: cukrzyca, nadciśnienie tętnicze, wcześniejsze operacje oczu, błona nasiatkówkowa i powikłana ekstrakcja zaćmy. (Heier JS, et al.) Biorąc pod uwagę, że wiele różnych schorzeń medycznych i okulistycznych może predysponować pacjentów do rozwoju PCME, identyfikacja tych pacjentów i agresywna terapia profilaktyczna miejscowymi NLPZ powinna być stosowana w celu zmniejszenia ryzyka rozwoju PCME.
Leczenie
– NLPZ. Ta klasa leków hamuje produkcję prostaglandyn poprzez hamowanie szlaku COX (patrz rys. 1). Ponieważ NLPZ nie mają wpływu na wcześniej wytworzone lub istniejące poziomy prostaglandyn, leczenie przed urazem chirurgicznym jest niezbędne. W jednym z ostatnich artykułów przeglądowych autor zalecił przedoperacyjne leczenie NLPZ przez dwa dni u pacjentów z grupy niskiego ryzyka i przez tydzień u pacjentów z grupy wysokiego ryzyka, z kontynuacją przez co najmniej cztery tygodnie po zabiegu w obu grupach.12
Wciąż istnieją pytania, który NLPZ jest najskuteczniejszy w zapobieganiu lub leczeniu PCME. LPZ nowszej generacji, takie jak bromfenak sodowy (Xibrom) i nepafenak, mają zmodyfikowaną strukturę chemiczną, co zwiększa ich penetrację do oczu i teoretyczną siłę działania.13 W badaniach in vitro stwierdzono, że względna siła hamowania COX-2 jest 18 razy większa w przypadku bromfenaku niż ketorolaku, chociaż znaczenie kliniczne tych danych nie jest znane.14 Badanie farmakokinetyki in vivo wykazało, że stężenie w wodnistym płynie żołądkowym dostępnego w handlu nepafenaku (nepafenak plus amfenak) jest znacznie większe niż stężenie bromfenaku lub ketorolaku.15 Nie wiadomo jednak, czy te różnice w penetracji przekładają się na poprawę wyników klinicznych. Mimo licznych informacji marketingowych sugerujących, że lepsza penetracja, zmiany strukturalne i większa proponowana siła działania NLPZ nowszej generacji przekładają się na większą skuteczność kliniczną, nie przeprowadzono ostatecznego badania, które by to potwierdziło.
– Terapia skojarzona. W randomizowanym, podwójnie maskowanym, prospektywnym badaniu oceniającym leczenie ketorolakiem i prednizolonem w porównaniu z terapią skojarzoną w przypadku klinicznie istotnego PCME stwierdzono, że pacjenci otrzymujący terapię skojarzoną osiągnęli średnią zmianę o ≥2 linie widzenia podczas drugiej wizyty, podczas gdy pacjenci w dwóch grupach stosujących monoterapię nigdy nie osiągnęli średniej poprawy o dwie linie w trzymiesięcznej obserwacji.16 Pacjenci leczeni albo terapią skojarzoną albo samym ketorolakiem również reagowali szybciej niż pacjenci w grupie prednizolonu.
– Zastrzyki kortykosteroidowe. Kortykosteroidy działają dalej na tej samej ścieżce co NLPZ, hamując uwalnianie kwasu arachadonowego z fosfolipidów błony komórkowej, zapobiegając w ten sposób powstawaniu leukotrienów i prostaglandyn (patrz rys. 1).
Nadal toczą się dyskusje dotyczące najskuteczniejszej drogi podania (podtorebkowo versus dożylnie), optymalnej dawki (4 mg versus większa) i bezpieczeństwa pacjenta (ryzyko nadciśnienia ocznego, odwarstwienia siatkówki, krwotoku do ciała szklistego i endophthalmitis). becnie nie istnieją żadne randomizowane badania kliniczne oceniające te sposoby leczenia, a opublikowane wyniki wydają się sprzeczne.
Jedna grupa badaczy stwierdziła, że stosowanie triamcynolonu doszklistkowo w leczeniu przetrwałego PCME spowodowało poprawę ostrości wzroku, zmniejszenie grubości plamki i zwiększenie wartości wieloogniskowego elektroretinogramu.17 Inny donosił, że zastosowanie 4 mg IVTA w przewlekłym opornym na leczenie PCME spowodowało poprawę anatomiczną i czynnościową po miesiącu od wstrzyknięcia i utrzymującą się przez co najmniej trzy miesiące.18 Korzystny efekt był jednak przejściowy, ponieważ ostrość wzroku i grubość plamki powróciły do wartości sprzed wstrzyknięcia mimo wielokrotnego leczenia. W jeszcze innej małej serii pacjenci utrzymywali poprawę ostrości wzroku i zmniejszenie grubości plamki po podaniu pojedynczej dawki 4 mg IVTA w przypadku opornego na leczenie PCME.19
– Acetazolamid. Acetazolamid zwiększa transport płynu podsiatkówkowego i wykazano, że usuwa obrzęk torbielowaty siatkówki w takich zaburzeniach, jak retinitis pigmentosa, afakia i tworzenie błony nadsiatkówkowej w plamce.20-23 Istnieje kilka opisów przypadków korelujących z ustąpieniem PCME po zastosowaniu doustnego acetazolamidu, ale do tej pory nie przeprowadzono badań klinicznych.
– Leki przeciw czynnikowi wzrostu śródbłonka naczyniowego. Uraz chirurgiczny prowadzi do zapalenia pooperacyjnego, które może prowadzić do PCME poprzez zwiększenie produkcji czynników wazoprzepuszczalnych, takich jak czynnik wzrostu śródbłonka naczyniowego. Również w tym przypadku małe serie przypadków dostarczają sprzecznych dowodów. Po dożylnym podaniu bevacizumabu (Avastin) jedna z grup stwierdziła, że 71% pacjentów uzyskało dwie lub więcej linii widzenia w skali ETDRS;24 a inna grupa donosiła, że we wszystkich oczach w ich serii nastąpiła statystycznie istotna poprawa widzenia.25 Jednak w innym badaniu stwierdzono, że dożylny bevacizumab nie poprawił ostrości wzroku u pacjentów z PCME.26
– Witrektomia. Witrektomia pars plana z odwarstwieniem błony może być rozważana w przypadkach PCME z komponentem mechanicznym, zidentyfikowanym w badaniu klinicznym lub OCT, lub w przypadkach przewlekłego opornego obrzęku niereagującego na leczenie. W niewielkiej serii przypadków interwencja chirurgiczna spowodowała poprawę ostrości wzroku o ponad trzy linie u większości pacjentów i ustąpienie PCME we wszystkich przypadkach.27 W literaturze istnieją również opisy przypadków wskazujące na poprawę widzenia po witrektomii i złuszczeniu błony ograniczającej wewnętrznej.28 Jak wspomniano wcześniej, witrektomia pars plana powinna być rozważona w przypadku zatrzymanych fragmentów soczewki, nieprawidłowej pozycji IOL lub zakażenia P. acnes.
Przyszłe kierunki
Jak wspomniano wcześniej, kortykosteroidy działają na początku kaskady zapalnej. Posurdex (Allergan) jest biodegradowalnym systemem trwałego dostarczania deksametazonu, który jest wszczepiany do jamy ciała szklistego. Jego matryca polimerowa stopniowo przekształca się w kwas mlekowy i glikolowy, które z kolei są rozkładane na wodę i dwutlenek węgla. W badaniu II fazy 54 procent pacjentów cierpiących na PCME i CME związane z zapaleniem błony naczyniowej oka wykazało poprawę ostrości wzroku o co najmniej 10 liter w 90. dniu po wszczepieniu implantu, w porównaniu do zaledwie 14 procent wykazujących podobny wynik w grupie obserwacyjnej.
Ostatnio FDA zatwierdziła Triesence (Alcon), acetonid triamcynolonu, do wstrzykiwania dożylnego podczas operacji. Lek ten może być stosowany off-label w algorytmie leczenia nawracającego PCME.
Jest oczywiste, że definicja PCME ewoluowała w ciągu ostatnich lat. Przy około 3 milionach operacji zaćmy wykonywanych rocznie w Stanach Zjednoczonych i zwiększonych oczekiwaniach pacjentów, ważne jest, aby specjaliści zajmujący się siatkówką rozumieli zróżnicowaną patogenezę, czynniki ryzyka i właściwe postępowanie w przypadku PCME. Nowe technologie zrewolucjonizowały i będą rewolucjonizować diagnostykę, rokowanie i leczenie tego schorzenia.
Autorzy prowadzą praktykę w Retinal Consultants of Arizona, Phoenix. Dr Jamal praktykuje również w Texas Retina Associates, Dallas, a dr Goldenberg w Associated Retinal Consultants, Royal Oak, Mich. Kontakt z Dr. Dugel pod adresem pdugel @gmail.com.
1. Irvine SR. Nowo zdefiniowany zespół ciała szklistego po operacji zaćmy. Am J Ophthalmol 1953; 36:599-619.
2. Gass JD, Norton EW. Follow-up study of cystoid macular edema following cataract extraction. Trans Am Acad Ophthalmol Otolaryngol 1969;73(4):665-82.
3. Wright PL, Wilkinson CP, Balyeat HD, et al. Angiographic cystoid macular edema after posterior chamber lens implantation. Arch Ophthalmol 1988;106:740-744.
4. Henderson BA, Kim JY, Ament CS, et al. Clinical pseudophakic cystoid macular edema. Risk factors for development and duration after treatment. J Cataract Refract Surg 2007;33:1550-8.
5. McColgin AZ, Raizman MB. Efficacy of topical Voltaren in reducing the incidence of post operative cystoid macular edema. Invest Ophthmol Vis Sci 1999;40 S289.
6. Donnenfeld ED, Perry HD, Wittpenn JR, et al. Przedoperacyjne ketorolac tromethamine 0,4 procent w wyników fakoemulsyfikacji: Pharmacokinetic-response curve. J Cataract Refract Surg 2006;32:1474-82.
7. Almeida DR, Johnson D, Hollands H, Smallman D, et al. Effect of prophylactic nonsteroidal antiinflammatory drugs on cystoid macular edema assessed using optical coherence tomography quantification of total macular volume after cataract surgery. J Cataract Refract Surg 2008;34:64-9.
8. Wittpenn JR, Silverstein S, Heier J, et al. A Randomized, Masked Comparison of Topical Ketorolac 0,4 percent Plus Steroid vs Steroid Alone in Low-Risk Cataract Surgery Patients. Am J Ophthalmol 2008; 146:554 -560.
9. Yavas GF, Oztürk F, Küsbeci T. Preoperative topical indomethacin to prevent pseudophakic cystoid macular edema. J Cataract Refract Surg 2007;33:804-7.
10. Wolf EJ, Braunstein A, Shih C, et al. Incidence of visually significant pseudophakic macular edema after uneventful phacoemulsification in patients treated with nepafenac. J Cataract Refract Surg 2007;33:1546-1549.
11. Asano S, Miyake K, Ota I, et al. Reducing angiographic cystoid macular edema and blood-aqueous barrier disruption after small-incision phacoemulsification and foldable intraocular lens implantation: Multicenter prospective randomized comparison of topical diclofenac 0.1 percent and betamethasone 0.1 percent. J Cataract Refract Surg 2008;34:57-63.
12. O’Brien TP. Emerging guidelines for use of NSAID therapy to optimized cataract surgery patient care. Curr Med Res & Opin. 2005;21:1131-1137.
13. Walsh DA, Moran HW, Shamblee DA, et al. Środki przeciwzapalne 3. Synteza i ocena farmakologiczna kwasu 2-amino-3-benzoilo-fenylooctowego i analogów. J Medicinal Chem 1984;27:1379-1388.
14. Waterbury LD, Silliman D, Jolas T. Comparison of cyclooxygenase inhibitory activity and ocular anti-inflammatory effects of ketorolac tromethamine and bromfenac sodium. Curr Med Res Opin 2006;22: 1133-1140.
15. Walters TR, Raizman M, Ernest P, et al. In vivo pharmacokinetics and in vitro pharmacodynamics of nepafenac, amfenac, ketorolac, and bromfenac. J Cataract Refract Surg 2007;33;1539-1545.
16. Heier JS, Topping TM, Baumann W, et al. Ketorolac versus prednisolone versus combination therapy in the treatment of acute pseudophakic cystoid macular edema. Ophthalmology 2000;107:2034-8.
17. Koutsandrea C, Moschos MM, Brouzas D, et al. Intraocular triamcinolone acetonide for pseudophakic cystoid macular edema: Optical coherence tomography and multifocal electroretinography study. Retina 2007;27:159-64.
18. Boscia F, Furino C, Dammacco R, et al. Intravitreal triamcinolone acetonide in refractory pseudophakic cystoid macular edema: Functional and anatomic results. Eur J Ophthalmol 2005;15:89-95.
19. Karacorlu M, Ozdemir H, Karacorlu S. Intravitreal triamcinolone acetonide for the treatment of chronic pseudophakic cystoid macular oedema. Acta Ophthalmol Scand 2003;81:648-52.
20. Marmor MF. Hypothesis concerning carbonic anhydrase treatment of CME: Example with epiretinal membrane. Arch Ophthalmol 1990;108:1524-1525.
21. Cox SN, Hay E, Bird AC. Treatment of chronic macular edema with acetazolamide. Arch Ophthalmol 1988;106:1190-1195.
22. Fishman GA, Gilbert COT, Fiscella RG et al. Acetazolamid w leczeniu przewlekłego obrzęku plamki w retinitis pigmentosa. Arch Ophthalmol 1989;107:1445-1452.
23. Wolfensberger TJ, Chiang R, Takeuchi A et al. Inhibition of membrane-bound carbonic anhydrase enhances subretinal fluid absorption and retinal adhesiveness. Graefe’s Arch Clin Exp Ophthalmol 2000; 238:76-80.
24. Arevalo JF, Garcia-Amaris RA, Roca JA, et al. Primary intravitreal bevacizumab for the management of pseudophakic cystoid macular edema: Pilot study of the Pan-American Collaborative Retina Study Group. J Cataract Refract Surg. 2007;33:2098-105.
25. Barone A, Russo V, Prascina F, et al. Short-term safety and efficacy of Intravitreal Bevacizumab for Pseudophakic Cystoid Macular Edema. Retina 2008 Oct 9.
26. Spitzer MS, Ziemssen F, Yoeruek E, et al. Efficacy of intravitreal bevacizumab in treating postoperative pseudophakic cystoid macular edema. J Cataract Refract Surg 2008;34:70-5.
27. Pendergast SD, Margherio RR, Williams GA, et al. Vitrectomy for chronic pseudophakic cystoid macular edema. Am J Ophthalmol 1999;128:317-23.
28. Peyman GA, Canakis C, Livir-Rallatos C, et al. The effect of internal limiting membrane peeling on chronic recalcitrant pseudophakic cystoid macular edema: A report of two cases. Am J Ophthalmol 2002;133:571-2.