Serowate PED w AMD
Odwarstwienie nabłonka barwnikowego siatkówki (PED) jest częścią spektrum klinicznego zwyrodnienia plamki związanego z wiekiem (AMD).
Jednakże w literaturze opisywano różne typy PED, które były związane lub nie z AMD.
Seropochodne PED jest definiowane jako obszar ostro odgraniczonego, kopulastego, surowiczego wyniesienia nabłonka barwnikowego siatkówki (RPE). Histopatologia surowiczego PED jest zgodna z odwarstwieniem błony podstawnej RPE wraz z leżącym nad nią RPE od pozostałej błony Brucha z powodu nagromadzenia płynu(1).
Występowanie tej zmiany jest negatywnym czynnikiem prognostycznym dla AMD pod względem ostrości wzroku.
Chociaż do tej pory nie ustalono jednoznacznych wskazań terapeutycznych, wczesne wykrycie surowiczego PED jest ważne dla rokowania i postępowania z pacjentami z AMD.
W AMD surowicze PED może być związane lub nie z naczyniówkami (choroidal neovascularization – CNV). Jednak typ unaczyniony jest zdecydowanie najczęściej obserwowany.
Proponowano wiele teorii dotyczących związku między surowiczym PED a CNV.
W celu wyjaśnienia patogenezy tego schorzenia Gass zaproponował, aby w obrębie grubości błony Brucha powstawały nowe naczynia z naczyniówki (neowaskularyzacja typu 1 – NV), które aktywnie przeciekają, zwiększając ciśnienie hydrostatyczne i powodując oderwanie RPE od mniej przylegających warstw(2).
Koncepcja ta została później poparta dowodami, że rozwojowi CNV towarzyszą mechanizmy zapalne, które dodatkowo uszkadzają błonę Brucha, wspierając oddzielenie RPE od wewnętrznej warstwy kolagenowej(3-5).
Gdy wzrost nowych naczyń zaczyna się od wewnętrznej siatkówki, ostatnio opisywany jako NV typu 3 i znany również jako siatkówkowa proliferacja naczyniopochodna (RAP), wysunięto hipotezę, że surowicze tworzenie się PED, które jest bardzo często związane, może być związane z inwazją RPE przez kompleks neowaskularny6-8).
W przeciwieństwie do tego, inni autorzy zaobserwowali, że obecność PED może reprezentować istniejący wcześniej stan, który może promować wzrost CNV poprzez dalsze uszkodzenie błony Brucha, będące wyrazem tej samej toczącej się choroby(9,10).
Pomimo, że patogeneza PED nie jest w pełni poznana, na podstawie tych badań można stwierdzić, że tworzenie NV wydaje się być momentem kluczowym.
W badaniu dna oka surowiczy PED pojawia się jako okrągły lub owalny, wyraźny obszar w kształcie kopuły, w którym dochodzi do regularnego odwarstwienia RPE i leżącej nad nim siatkówki neurosensorycznej, o kolorze żółtym do pomarańczowego i gładkiej powierzchni. Marginesy są zazwyczaj ostro odgraniczone; często obserwuje się ogniskową atrofię RPE i figury pigmentowe(9,11).
Jednakże równoczesna obecność NV może generować różne powiązane aspekty oftalmoskopowe, takie jak komponenty krwotoczne i wysiękowe, obszary nieregularnego wyniesienia RPE i surowicze odwarstwienie otaczającej neurosiatkówki.
Prezentacja NV typu 1 zlokalizowanego na marginesie PED może być różna, zwykle skutkując aspektem reniformalnym lub karbowanym, lub płasko-bocznym odwarstwieniem RPE(12).
Serowaty PED może być obrazowany za pomocą angiografii fluoresceinowej (FA), angiografii z użyciem zieleni indocyjaninowej (ICGA) i optycznej koherentnej tomografii (OCT).
FA stanowi jednak złoty standard w diagnostyce serowatego PED.
Badany za pomocą FA, surowiczy PED klasycznie wykazuje wczesną jednorodną hiperfluorescencję całej zmiany, nieco opóźnioną w stosunku do fluorescencji tła, która stopniowo zwiększa swoją jasność w miarę postępu badania (pooling).
Surowiczy PED hiperfluorescencja zazwyczaj nie zmienia rozmiaru ani kształtu podczas faz angiograficznych.
FA może również wykazać obecność NV, zwykle związanego z surowiczym PED jako NV typu 1, jak obszary niewyraźnego późnego barwienia podsiatkówkowego, bardziej widoczne, gdy znajdują się na marginesie odwarstwienia RPE lub odpowiadają „wcięciu”(11).
Obecność NV można również wywnioskować na podstawie obecności krwotocznego komponentu PED, ciemnego menisku opisanego przez Gassa(12).
Jednakże bardziej precyzyjną lokalizację komponentu neowaskularnego można uzyskać za pomocą cyfrowego ICGA. Cząsteczka zieleni indocyjaninowej ma właściwości biofizyczne, które w odróżnieniu od fluoresceiny umożliwiają uwidocznienie anatomii naczyń poprzez RPE, krew i wysięk mętny.
Szczegółowo ICGA pozwala lepiej określić obecność i rodzaj nowych naczyń związanych z surowiczym PED i z tego powodu jest uważana za podstawowe narzędzie w leczeniu tej choroby(13-15).
W badaniu ICGA surowiczy PED jawi się jako zmiana hipofluorescencyjna, z ostro zarysowanymi brzegami, która pozostaje stale hipofluorescencyjna we wszystkich fazach badania(16).
Gdy nowe naczynia nie są obecne, nie można wykryć żadnych oznak zlokalizowanych obszarów hiperfluorescencyjnych; zarys PED jest ostro zaokrąglony i dlatego jest on uważany za czysty surowiczy PED.
W grupie pacjentów z AMD Yannuzzi stwierdził częstość występowania 4% nienaczyniowych PED wśród surowiczych PED(15).
Gdy obecny jest komponent neowaskularny, zaproponowano termin unaczyniony PED(15),.które stanowi około 24% nowo rozpoznanego wysiękowego AMD(17).
Nowe naczynia związane z surowiczym PED są reprezentowane w różnych podtypach.
Wideoangiografia o dużej prędkości z użyciem skaningowego oftalmoskopu laserowego wydaje się cennym narzędziem, które pozwala okuliście zidentyfikować wzór nowych naczyń i ich zachowanie angiograficzne(18).
Rozpoznanie różnych typów NV, poprzez rozróżnienie wyników angiograficznych, jest obowiązkowe ze względu na odmienny przebieg naturalny, rokowanie wzrokowe i różną odpowiedź na leczenie trzech głównych rodzajów nowych naczyń związanych z surowiczym PED w AMD.
Najczęstszym typem nowych naczyń związanych z surowiczym PED są te, które powstają w naczyniówce pod monowarstwą RPE(15-,17).
Te nowe naczynia zostały ostatnio sklasyfikowane jako NV typu 1 i są zdecydowanie najczęstszym typem NV w AMD(19)(Rycina 1).

Rycina 1 – Unaczyniony PED z NV typu 1. (A) FA, (B) ICGA i (C) OCT.
W początkowych fazach ICGA pokazuje tętnicę doprowadzającą NV, która powstaje z krążenia naczyniówkowego, a następnie drenującą żyłę.
W tym samym czasie można wykryć sieć kapilar błony neowaskularnej.
W przeciwieństwie do fluoresceiny, zieleń indocyjaninowa przecieka nieznacznie, a hiperfluorescencja NV jest zwykle minimalna, z wyjątkiem niektórych przypadków wykazujących intensywny przeciek, uważanych za bardzo aktywne nowe naczynia.
Często, w późnych fazach, dobrze zdefiniowany obszar łagodnej hiperfluorescencji odpowiadający sieci NV może być zauważalny.
Drugim typem nowych naczyń powikłanych surowiczym PED są RAP(7,20-22), określane również jako NV typu 3(19).
Te zmiany naczyniowe, jak donoszą różni autorzy, mogą obejmować siatkówkę zewnętrzną i RPE, poprzez progresję, która, jak się przypuszcza, pochodzi z krążenia siatkówkowego i/lub naczyniówki.
ICGA typowo wykazuje obecność „gorącego punktu”, spowodowanego wczesną hiperfluorescencją wewnątrzsiatkówkowego kompleksu neowaskularnego, która wzrasta podczas angiografii, z intensywnym przeciekiem w późnych fazach.
Jasność jest wzmocniona przez otaczającą hipofluorescencję leżącego u podłoża PED (Rysunek 2).
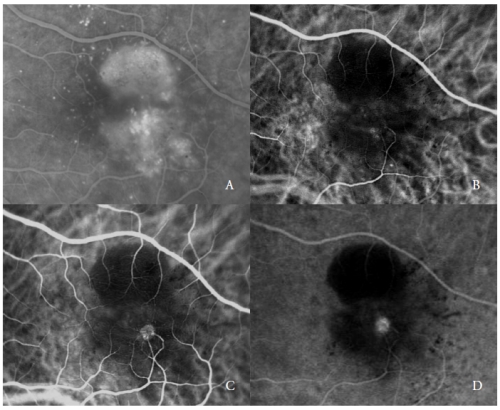
Rysunek 2 – Unaczyniony PED z NV typu 3 (RAP). FA (A) i ICGA wczesna (B) i późna faza (C i D).
W późnych stadiach choroby naczyniówkowy kompleks neowaskularny jest zwykle połączony z jednym lub kilkoma naczyniami siatkówki, które wydają się kręte i poszerzone(7,22,23).
Typ 3 NV może być pojedynczy lub mnogi, jego pochodzenie jest zwykle pozagałkowe, często obserwuje się krwotok śródsiatkówkowy w korespondencji ze zmianą neowaskularną(20).
Trzeci typ nowych naczyń związany z surowiczym PED w AMD odpowiada polipoidalnej naczyniówce naczyniówkowej (polypoidal choroidal vasculopathy, PCV)(24).
PCV jest szczególną postacią CNV, charakteryzującą się obecnością pomarańczowych, tętniakowatych, polipowatych, okrągłych poszerzeń na granicy rozgałęzionej sieci naczyniowej pochodzenia naczyniowego.
Chociaż PCV częściej dotyczy populacji czarnoskórych i azjatyckich w średnim wieku, jej spektrum kliniczne rozszerza się na białych, gdzie stwierdza się jej obecność u 8-13% pacjentów z towarzyszącymi zmianami w AMD.
W tych przypadkach, gdy obecne są objawy przypisywane zarówno PCV, jak i AMD, niektórzy autorzy uważają PCV za podtyp CNV w AMD(24,25).
Objawy krwotoczne są częste u pacjentów z PCV.
Serowate PED związane z PCV często wykazuje poziom krwi w dolnej części odwarstwienia.
ICGA jest najnowocześniejszym badaniem pozwalającym na odróżnienie typowych cech obu komponentów naczyniowych.
Sieć naczyniowa charakteryzuje się obecnością jednej lub więcej zmian tętniakowatych, które wykazują jasną fluorescencję od wczesnych faz, po czym w późnych fazach następuje rozjaśnienie barwnika, zwane „wash-out”, typowe dla tej choroby (Rycina 3).
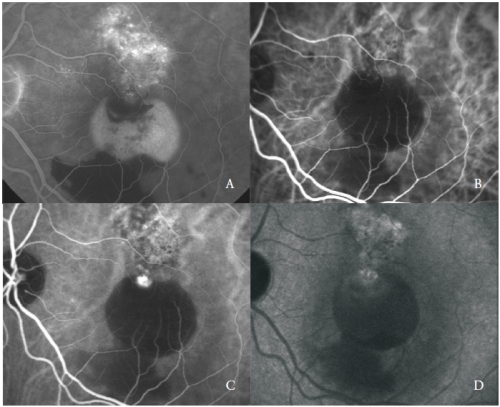
Rysunek 3 – Unaczyniony PED z PCV: FA (A) oraz wczesne (B), średnie (C) i późne (D) fazy ICGA.
Niemniej jednak, niektóre struktury polipopodobne mogą aktywnie przeciekać wykazując późne barwienie ich ścian i otaczającej wysiękowej wydzieliny.
Zmiany polipowate są zwykle zlokalizowane na marginesie surowiczego PED(26).
Rozpoznanie tych zmian jest krytyczne ze względu na ich odmienny przebieg kliniczny, rokowanie i odpowiedź na leczenie w porównaniu z innymi podtypami neowaskularnego AMD.
OCT dostarcza obrazów, które pozwalają na dokładną korelację z wynikami badań angiograficznych.
W przekrojowych skanach OCT, surowiczy PED pojawia się jako optycznie puste, kopulaste uniesienie zewnętrznego pasma wysokiego odbicia światła – RPE, które stromo odchodzi od błony Brucha(26).
Następująca siatkówka, zwykle przylegająca do pęcherzykowego PED, na obrzeżach zmiany może być nieznacznie oderwana od RPE.
Więcej dodatkowych informacji może dostarczyć OCT w unaczynionym PED(28).
W przekrojach tomograficznych, prowadzonych przez FA i ICGA w obszarze odpowiadającym CNV, widać gładsze uniesienie RPE, ciągłe z odwarstwieniem surowiczym, z głębszym rozpraszaniem wstecznym, wynikającym z obecności tkanki włóknisto-naczyniowej.
Hiporefleksyjne obszary jednorodnych optycznie pustych przestrzeni odnoszące się do akumulacji płynu są często obecne w przestrzeniach podsiatkówkowych i wewnątrzsiatkówkowych(29).
Wewnątrzsiatkówkowe optycznie puste przestrzenie są bardziej widoczne, gdy surowicze PED jest związane z NV typu 3, szczególnie o kształcie torbielowatym (ryc. 4).
Umieszczając linię skanowania odpowiadającą „gorącemu punktowi”, nieprawidłowość neowaskularna jest przedstawiana jako gęsta lub hiperrefleksyjna strefa przednabłonkowa w wewnętrznych warstwach siatkówki, gdzie zewnętrzne warstwy hiperrefleksyjne nie są już wykrywalne(30).
PRE w pobliżu tej zmiany często wykazuje wykwity lub przerwy w warstwie hiperrefleksyjnej(31).
Pomiar topograficzny siatkówki wykazuje zwiększoną grubość siatkówki.
W oczach z surowiczym PED i PCV zmiany polipowate wykazują ostrą wypukłość RPE, podobną do PED, ale stromo nachyloną.
Jama polipa, zwykle optycznie pusta, przylega do nieregularnego uniesienia RPE, co jest wyrazem ukrytego neowaskularnego komponentu zmiany(32,33).
Płyn podsiatkówkowy i śródsiatkówkowy, obserwowane jako hipofluorescencyjne obszary optycznie puste, są związane z aktywnością PCV (Rycina 4-B).
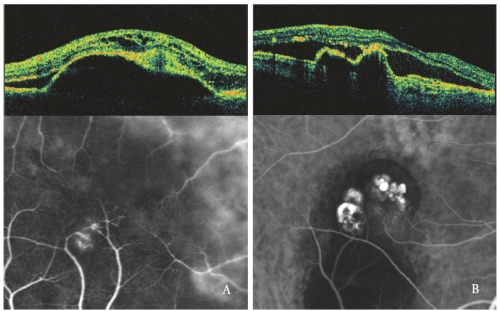
Rycina 4 – Typ 3 NV (RAP) (po lewej) i PCV (po prawej): Wzorce OCT i ICGA.
Ostatnio wprowadzona angiografia OCT (OCT-A) umożliwiła obrazowanie perfuzji różnych warstw siatkówki bez wstrzykiwania barwnika i dzięki wykorzystaniu przepływu endoluminalnego jako wewnętrznego kontrastu.
Rycina 5 przedstawia przykład, jak OCT-A obrazuje sieć naczyniówkową w przypadku PCV.
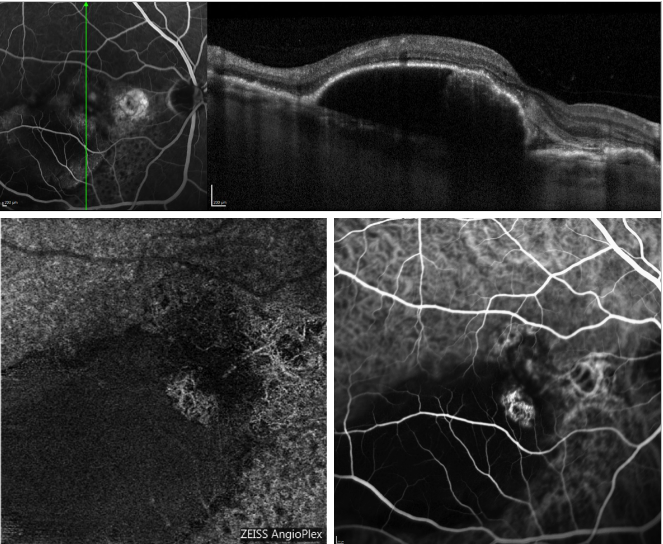
Rycina 5 – Surowiczy PED i nawracające PCV (FA, OCT, ICGA i OCT-A). Na górze skan OCT uzyskany równocześnie z FA; na dole wygląd profilu polipów na OCT-A (po lewej) i ICGA (po prawej).
Jednakże statyczny charakter tego badania i obecność możliwych artefaktów są istotnymi ograniczeniami, które należy brać pod uwagę.
W odniesieniu do surowiczego PED, cieniowanie spowodowane utratą transmisji sygnału w korespondencji z PED może utrudniać wykrycie kompleksu CNV na OCT-A (Rycina 6).
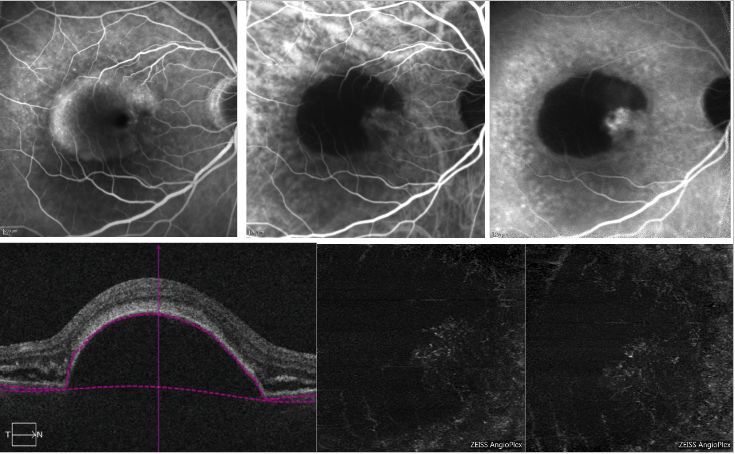
Rycina 6 – Unaczyniony PED i surowiczy PED z NV typu 1 (FA, ICGA i OCT-A) . Na górze, FA (po lewej) pokazuje zbieranie się barwnika spowodowane obecnością surowiczego PED; ICGA (u góry pośrodku i po prawej) pokazuje sieć neowaskularną na brzegu PED (nacięcie); na dole, OCT-A nie daje jednoznacznego obrazu sieci neowaskularnej.
Przebieg naturalny surowiczego PED zależy od obecności lub nie komponentu neowaskularnego(34).
W czystym surowiczym PED występuje na ogół powolne powiększanie się zmiany, z minimalną progresją utraty wzroku w długim okresie (miesiące lub lata).
Jednakże w wielu przypadkach może później dojść do rozwoju neowaskularyzacji, która pogarsza stan(35).
Naturalny przebieg w unaczynionym PED może być różny i jest związany z rodzajem związanych z nim nowych naczyń.
Najczęstszym ostrym powikłaniem PED jest rozdarcie RPE(36-39).
Zazwyczaj występuje ono na brzegu PED, na przecięciu oderwanego i dołączonego RPE.
Klinicznie, rozdarcie lub rozerwanie RPE pojawia się jako dobrze zdefiniowany obszar gołego naczyniówki, przylegający do ciemniejszego hiperpigmentowanego obszaru dywanowego, odpowiadającego kopcowi RPE, który uległ rozerwaniu(40,41).
Rozerwane RPE zwykle toczy się w kierunku CNV, a jego skłonność do rozerwania można przewidzieć na podstawie obserwacji cech poprzedzających rozerwanie, takich jak zwiększenie rozmiaru i modyfikacja kształtu, obecność małych otworów na brzegach PED, obecność krwotoków lub płynu podsiatkówkowego, ale na uwagę zasługuje przede wszystkim nieregularne wypełnienie PED widoczne na FA, wysokość PED > 580 nm, czas trwania > 4.5 miesięcy, hiperrefleksyjne linie promieniste w obrazowaniu bliskiego odbicia, mniejszy stosunek unaczynionych PED i terapia anty-VEGF (anti-vascular endothelial growth factor)(42-46).
RPE łzawianie występuje samoistnie lub po leczeniu, formalnie fotokoagulacji laserowej, terapii fotodynamicznej i dożylnych iniekcjach steroidów lub leków anty-VEGF(47- 58).
Dokładna patogeneza łez RPE jest słabo poznana.
W odniesieniu do naturalnego przebiegu PED wysunięto hipotezę, że styczne siły ścinające w PED mogą powodować przerwanie błony podstawnej RPE na brzegu odwarstwienia, jednak bardziej prawdopodobne jest, że jest to wynik działania kilku zmiennych, w których główną rolę odgrywa obecność CNV.
Donoszono o kilku związkach przyczynowych w przypadku rozerwania RPE występującego po leczeniu, w tym o cieple wytworzonym przez fotokoagulację, nagłym wzroście ilości płynu wewnątrz dotorebkowego, skurczeniu się CNV i jednoczesnym nagłym ustąpieniu płynu pod RPE.
Połączona obecność trakcji szklistkowo-macicznej i deformacja globusa spowodowana mechanicznym urazem przez igłę również zostały zgłoszone jako czynniki sprawcze(59).
Po rozerwaniu RPE większość pacjentów skarży się na nagłe, poważne pogorszenie widzenia.
W niewielkim odsetku oczu, w których łza omija fowię, pacjenci mogą doświadczać przejściowego zachowania dobrej funkcji wzrokowej(60).
Jednakże w dłuższej perspektywie progresja blizny podsiatkówkowej prowadzi do poważnego pogorszenia widzenia. W rokowaniu w przypadku surowiczych PED należy również uwzględnić wysokie ryzyko obustronnego zajęcia(61).
Leczenie surowiczych PED, związanych lub nie z CNV, zawsze stanowiło wyzwanie i jak dotąd nie ma rekomendowanych wytycznych dotyczących ich postępowania.
Czysto surowicze PED były w przeszłości leczone za pomocą siatki laserowej lub fotokoagulacji rozproszonej, jednak z rozczarowującymi wynikami(61).
Leczenie surowiczych PED, związanych lub nie z CNV, zawsze stanowiło wyzwanie i jak dotąd nie ma zalecanych wytycznych postępowania. Czysto surowicze PED były w przeszłości leczone za pomocą siatki laserowej lub fotokoagulacji rozproszonej, z rozczarowującymi wynikami(62).
Nie próbowano innych metod leczenia tych zmian.
Gdy obecna jest sieć neowaskularna, leczenie surowiczych PED koncentrowało się na leczeniu CNV. Jednak biorąc pod uwagę, że unaczynione PED nigdy nie zostały włączone do dużych randomizowanych badań kontrolowanych, decyzję o leczeniu musimy podejmować na podstawie opublikowanych małych serii, które często są retrospektywne i dotyczą różnych metod terapeutycznych.
Obecnie, w erze terapii anty-VEGF, wszystkie dotychczas stosowane metody leczenia wydają się niezadowalające.
Fotokoagulacja laserowa była szeroko stosowana i nadal może mieć ograniczone wskazania, gdy CNV dobrze zdefiniowane w badaniu ICGA leży daleko od oderwanego RPE(63).
Samodzielna terapia fotodynamiczna (PDT) z zastosowaniem werteporfiny okazała się szkodliwa, zwiększając ryzyko rozerwania RPE, krwotoków i nagłego obniżenia ostrości wzroku(39,48,49,64) (ryc. 7).
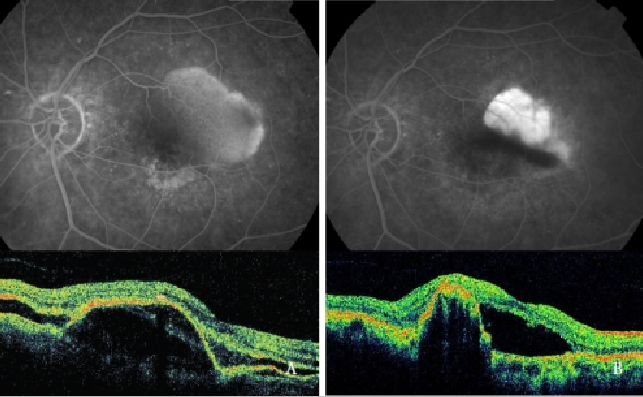
Rycena 7 – Unaczyniony PED z CNV (Typ 1 NV) przed (po lewej) i po (po prawej) PDT: RPE tear (FA i OCT).
Jednakże wykazano, że PDT w połączeniu z dożylną iniekcją acetonidu triamcynolonu (IVTA) może potencjalnie przyczynić się do stabilizacji ostrości wzroku i redukcji nawrotów(65).
Niemniej jednak wysoki odsetek powikłań (zaćma i jaskra) ograniczył stosowanie dożylnego triamcynolonu.
Po zachęcających wynikach uzyskanych przy zastosowaniu dożylnej terapii anty-VEGF w leczeniu utajonych CNV, zastosowanie leczenia anty-VEGF zostało rozszerzone na unaczynione PED z rozczarowującymi wynikami(66-69).
Zarówno ostre powikłania, jak i słaba odpowiedź anatomiczna na leczenie często unieważniają nasze próby wyleczenia zmiany. Zgłaszano, że rozdarcia RPE i krwotoki podsiatkówkowe są powikłaniem doogniskowego leczenia ranibizumabem i bevacizumabem(51-57).
Co więcej, płyn podsiatkówkowy słabo reaguje na terapię anty-VEGF, prawdopodobnie z powodu zmian wodoprzewodnictwa błony Brucha(69).
W retrospektywnej serii przypadków obejmującej 328 pacjentów leczonych odpowiednio bevacizumabem, ranibizumabem, pegaptanibem i PDT+IVTA, po średnim okresie obserwacji wynoszącym 42,4 tygodnia, autorzy odnotowali znaczącą stabilizację ostrości wzroku w każdej z grup, lepszą w grupie leczonej bevacizumabem i ranibizumabem w porównaniu z pozostałymi dwiema, oraz ogólną częstość łez RPE wynoszącą 12.5%.
Jednakże konkludują oni, że przy tych metodach leczenia można uzyskać jedynie częściową regresję zmian, a ryzyko przedarć RPE nie jest uniknione(69).
Inne retrospektywne badanie(58). dokonało przeglądu wyników pacjentów z unaczynionymi PED leczonych samą PDT, PDT w połączeniu z IVTA lub samymi dożylnymi iniekcjami anty-VEGF (bevacizumab lub ranibizumab) i wykazało lepsze wyniki czynnościowe w grupie leczonej anty-VEGF.
Co więcej, w tej serii, typ 1 NV z unaczynionym PED w porównaniu z typem 3 NV, wraz z lepszą ostrością wzroku na poziomie wyjściowym, wykazywał większe ryzyko ostrego rozerwania RPE po leczeniu(58).
W ostatnim prospektywnym badaniu(19), leczenie PED związanego z podtwardówkowym typem 1 NV za pomocą doszklistkowych iniekcji ranibizumabu i z 3-miesięczną fazą ładowania oraz strategią pro re nata doprowadziło do jedynie częściowych wyników w ciągu 24-miesięcznej obserwacji.
Ostatnio w kilku badaniach badano skuteczność leczenia PED w AMD za pomocą dożylnego afliberceptu, wykazując dobrą odpowiedź anatomiczną z poprawą lub brakiem istotnych zmian w ostrości wzroku(70-73).
Co więcej, wykazano, że dożylny aflibercept jest obiecującą metodą leczenia PED opornych na dożylne leczenie ranibizumabem(72-74).
W kilku badaniach zidentyfikowano czynniki, które mogą wpływać na odpowiedź PED na leczenie anty-VEGF(75-78).
Dirani i wsp.(75) wykazali, że lepsza poprawa wzroku była związana z niższą wyjściową ostrością wzroku, obecnością płynu podsiatkówkowego i RAP. Ponadto w ich serii redukcja PED była związana z wyższym PED na początku, przewagą surowiczego PED i stosowaniem afliberceptu.
Cho i wsp.(76) w ostatniej serii przypadków stwierdzili, że niższa wysokość PED na początku, PCV lub RAP w porównaniu z typowym neowaskularnym AMD, surowicze PED w porównaniu z włóknisto-naczyniowym PED i aflibercept w porównaniu z ranibizumabem, mają większą szansę na rozwiązanie PED podczas leczenia anty-VEGF PED.
Jednakże w niedawnej analizie post hoc randomizowanego badania kontrolowanego III fazy(77) wykazano, że w 24 miesiące po rozpoczęciu leczenia anty-VEGF u około połowy pacjentów z PED na początku stwierdzono całkowite ustąpienie PED, niezależnie od statusu PED i wzrostu na początku.
Ostatnio Chen i wsp.(78) podkreślili znaczenie różnicowania oczu prezentujących RAP, ponieważ mają one lepsze wyniki anatomiczne i funkcjonalne przy mniejszej liczbie iniekcji w porównaniu z PED z NV typu 1.
W przyszłości nowe terapie skojarzone i nowe strategie terapeutyczne, wraz z identyfikacją nowych biomarkerów klinicznych odpowiedzi na leczenie, pomogą poprawić rokowanie pacjentów dotkniętych unaczynionym PED.