Jak wskazano w poprzednich rozdziałach, polarna cząsteczka wody pozwala cząsteczkom wody na tworzenie wiązań między sobą. Wiązania te określane są jako wiązania wodorowe. Jeśli weźmiemy pod uwagę chlorek sodu (sól), związek zawierający wiązania jonowe, możemy wykazać, że po prostu umieszczając sól kuchenną w wodzie, na przykład, możemy zmniejszyć przyciąganie elektrostatyczne między jonami sodu i chlorku o 80 razy. Ponieważ coraz więcej jonów sodu i chloru uwalnia się w wyniku osłabienia przyciągania elektrostatycznego, które trzyma je razem, zostają one otoczone przez polarne cząsteczki wody – co określa się mianem „hydratacji”.”

Woda rozpuszcza więcej substancji niż jakakolwiek inna powszechna ciecz poprzez rozbicie „soli” na „jony” składowe (np. NaCl na Na+ i Cl-) i uwodnienie tych jonów, aby nie wchodziły ze sobą w interakcje. W ten sposób polarne cząsteczki wody przyciągają jony (atomy lub grupy atomów z ładunkiem), gdzie „kationy” są jonami z ładunkiem dodatnim, a „aniony” z ładunkiem ujemnym. Większość pierwiastków ma wysoką rozpuszczalność w wodzie, co oznacza, że duże stężenia tych pierwiastków mogą się nagromadzić, zanim zostanie przekroczona zdolność cząsteczek wody do izolowania jonów. Punkt, w którym Na i Cl, na przykład, zaczną się wytrącać jako sól w wodzie morskiej, określa się mianem „nasycenia”. W przypadku NaCl (minerał „halit”) występuje to tylko w dzisiejszej wodzie morskiej, kiedy następuje parowanie i objętość wody morskiej zmniejsza się do około 10% jej pierwotnej objętości.
Woda morska jest zasadniczo roztworem NaCl, którego średnie stężenie wynosi 35 g NaCl/kg wody (lub 3,5% soli). Na i Cl stanowią ponad 85% całkowitej zawartości rozpuszczonych substancji stałych (soli), ale są w niej obecne również inne ważne jony. Względna obfitość jonów w wodzie morskiej to w kolejności: Cl, Na, SO4, Mg, Ca, K. Razem jony te stanowią >99% rozpuszczonych substancji stałych w wodzie morskiej. Z czterema innymi pierwiastkami–HCO3 (wodorowęglan), Br, Sr, B, F– mamy 99,99% wszystkich rozpuszczonych ciał stałych. Ładunki muszą się równoważyć, więc ładunek dodatni związany z Na+, Mg+2, Ca+2, K+ równa się ładunkowi ujemnemu związanemu z Cl-, SO4-2 (i HCO3-). Nie sądzimy, abyś chciał, aby było inaczej. Pomyśl, jaki byłby przepływ prądu z morza do Ciebie, siedzącego na plaży, gdyby ładunki nie były zrównoważone – szokujące!
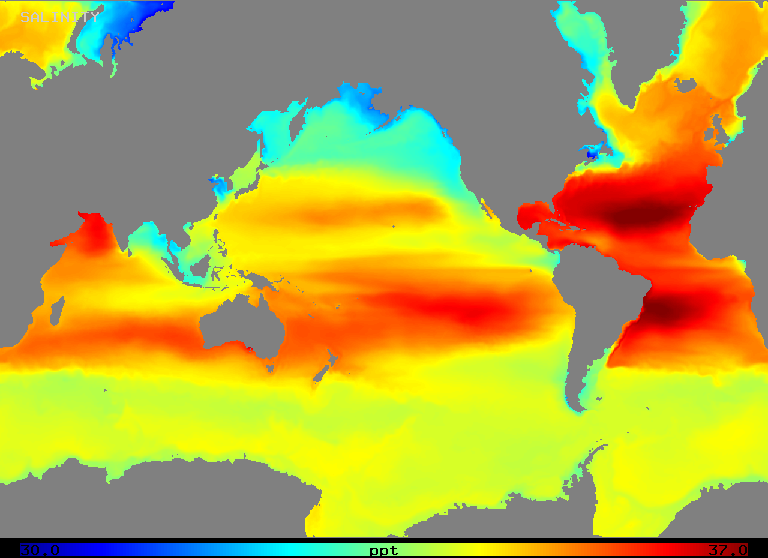
Zasolenie waha się w zakresie od około 32 do 37 o/oo w otwartym oceanie, jak ilustruje rysunek 2 (poniżej). Zauważmy, że obszary o najwyższym zasoleniu występują w regionach o najwyższym parowaniu netto, jak można by się spodziewać.
Wszystkie inne substancje rozpuszczone w wodzie morskiej występują w bardzo niskich stężeniach (część na milion lub miliard) (ppm lub ppb; 10-6 do 10-9). Obejmuje to ważne składniki odżywcze, takie jak fosforan i azotan, które są cyklicznie wykorzystywane przez organizmy (elementy zwane „bio-ograniczającymi”) i niezbędne do życia. Wiele metali występuje w stężeniach śladowych (chcesz się wzbogacić? W wodzie morskiej rozpuszczone jest około 9 milionów ton złota, co odpowiada mniej więcej całemu złotu wydobytemu na Ziemi na przestrzeni dziejów).
Jak już wcześniej wskazano, parowanie wody morskiej wytwarza przewidywalną sekwencję soli mineralnych (minerały stają się nasycone w pewnym momencie). Po odparowaniu kilku % masy wody wytrąca się CaCO3 (kalcyt); po odparowaniu 81%, CaSO4 (gips) jest całkowicie wytrącony; po odparowaniu około 90,5%, NaCl (halit) jest całkowicie wytrącony; przy 96% odparowaniu, sole K i Mg (w/ SO4 i Cl) odpadają. W oceanie znajduje się tyle soli, że można pokryć ląd warstwą o grubości 170 m. Naturalne osady z dawnych oceanów takie jak ten nazywane są „ewaporytami”.”