Wiązania wodorowe mogą tworzyć się między samotną parą na bardzo elektronegatywnym atomie azotu a lekko dodatnim atomem wodoru w innej cząsteczce.
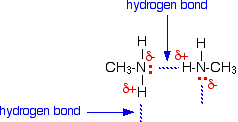
Wiązanie wodorowe nie jest tak wydajne jak w, powiedzmy, wodzie, ponieważ brakuje tam samotnych par. Niektóre lekko dodatnie atomy wodoru nie będą w stanie znaleźć samotnej pary do wiązania wodorowego. Jest dwa razy więcej odpowiednich hydrogenów niż samotnych par.
Punkty wrzenia amin pierwszorzędowych wzrastają wraz ze wzrostem długości łańcucha z powodu większej ilości sił rozpraszających van der Waalsa pomiędzy większymi cząsteczkami.
Aminy drugorzędowe
Aby dokonać rzetelnego porównania, należałoby porównać temperaturę wrzenia dimetyloaminy z etylaminą. Są one izomerami siebie nawzajem – każda z nich zawiera dokładnie taką samą liczbę takich samych atomów.
Punkt wrzenia aminy drugorzędowej jest nieco niższy niż odpowiadającej jej aminy pierwszorzędowej o tej samej liczbie atomów węgla.
Aminy drugorzędowe nadal tworzą wiązania wodorowe, ale obecność atomu azotu w środku łańcucha, a nie na jego końcu, powoduje, że stały dipol w cząsteczce jest nieco mniejszy.
Niższa temperatura wrzenia wynika z mniejszego przyciągania dipol-dipol w dimetyloaminie w porównaniu z etyloaminą.
Aminy trzeciorzędowe
Tym razem, aby dokonać rzetelnego porównania, należałoby porównać trimetyloaminę z jej izomerem 1-aminopropanem.
Jeśli spojrzysz na tabelę na górze strony, zobaczysz, że trimetyloamina ma znacznie niższą temperaturę wrzenia (3,5°C) niż 1-aminopropan (48,6°C).
W aminie trzeciorzędowej nie ma atomów wodoru przyłączonych bezpośrednio do azotu. Oznacza to, że wiązanie wodorowe między cząsteczkami amin trzeciorzędowych jest niemożliwe. Dlatego temperatura wrzenia jest znacznie niższa.
Rozpuszczalność w wodzie
Małe aminy wszystkich typów są bardzo dobrze rozpuszczalne w wodzie. W rzeczywistości te, które normalnie występują jako gazy w temperaturze pokojowej, są zazwyczaj sprzedawane jako roztwory w wodzie – w podobny sposób, w jaki amoniak jest zazwyczaj dostarczany jako roztwór amoniaku.
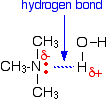
Wszystkie aminy mogą tworzyć wiązania wodorowe z wodą – nawet trzeciorzędowe.
Aminy trzeciorzędowe nie mają atomu wodoru związanego z azotem, więc nie mogą tworzyć wiązań wodorowych z samymi sobą, ale mogą tworzyć wiązania wodorowe z cząsteczkami wody, wykorzystując samotną parę na azocie.
Rozpuszczalność spada wraz z wydłużaniem się łańcuchów węglowodorowych – zauważalnie po około 6 karbonach. Łańcuchy węglowodorowe muszą torować sobie drogę między cząsteczkami wody, zrywając wiązania wodorowe między cząsteczkami wody.
Nie zastępują ich jednak niczym równie silnym, a więc proces tworzenia roztworu staje się coraz mniej energetycznie wykonalny wraz ze wzrostem długości łańcucha.
Zapach
Bardzo małe aminy, takie jak metyloamina i etyloamina, pachną bardzo podobnie do amoniaku – chociaż jeśli porównamy je obok siebie, zapachy amin są nieco bardziej złożone.
Jak aminy stają się większe, mają tendencję do zapachu bardziej „rybiego” lub zapachu rozkładu.
Jeśli znasz zapach kwiatu głogu (i podobnie pachnących rzeczy jak kwiat irgi), jest to zapach trimetyloaminy – słodki i raczej chorobliwy zapach jak wczesne stadia rozkładającego się ciała.
Pytania sprawdzające zrozumienie
Jeśli jest to pierwszy zestaw pytań, proszę przeczytaj stronę wprowadzającą zanim zaczniesz. Będziesz musiał użyć przycisku BACK BUTTON w swojej przeglądarce, aby wrócić tutaj po zakończeniu pracy.
Pytania dotyczące wprowadzenia do amin
odpowiedzi
Gdzie chciałbyś teraz pójść?
Do menu amin . . .
Do menu innych związków organicznych . .
Do menu głównego . . .