Cele nauczania
- Poznać podstawowe terminy używane do opisu materii.
Definicja chemii – badanie oddziaływań materii z inną materią i z energią – używa pewnych terminów, które również powinny być zdefiniowane. Naukę chemii rozpoczynamy od zdefiniowania kilku podstawowych pojęć.
Materia. Książka jest materią, komputer jest materią, jedzenie jest materią, a brud w ziemi jest materią. Czasami materia może być trudna do zidentyfikowania. Na przykład, powietrze jest materią, ale ponieważ jest tak cienkie w porównaniu z innymi materiami (np. książką, komputerem, jedzeniem i brudem), czasami zapominamy, że powietrze ma masę i zajmuje miejsce. Rzeczy, które nie są materią to myśli, idee, emocje i nadzieje.
Przykład 1
Które z poniższych jest materią a które nie jest materią?
- Hot dog
- miłość
- drzewo
Rozwiązanie
- Hot dog ma masę i zajmuje miejsce, więc jest materią.
- Miłość jest emocją, a emocje nie są materią.
- Drzewo ma masę i zajmuje miejsce, więc jest materią.
Testuj Siebie
Które z poniższych jest materią, a które nie jest materią?
- Księżyc
- pomysł na nowy wynalazek
Odpowiedź
- Księżyc jest materią.
- Wynalazek sam w sobie może być materią, ale pomysł na niego nie jest.
Figura 1.1 Fazy materii

„Kostki lodu” autorstwa Darrena Hestera jest udostępnione na licencji Creative Commons Attribution-Share Alike 2.5 Generic; „Szklanka wody” autorstwa Grega Rieglera jest udostępnione na licencji Creative Commons Attribution 2.0 Generic; Tea Time by Vélocia is licensed under the Creative Commons Attribution-NonCommercial- NoDerivs 2.0 Generic.
Aby zrozumieć materię i to, jak się zmienia, musimy być w stanie opisać materię. Istnieją dwa podstawowe sposoby opisywania materii: właściwości fizyczne i właściwości chemiczne. Właściwości fizyczne są cechami, które opisują materię, jak istnieje. Niektóre z wielu fizycznych cech materii to kształt, kolor, rozmiar i temperatura. Ważną właściwością fizyczną jest faza (lub stan) materii. Trzy podstawowe fazy materii to ciało stałe, ciecz i gaz (patrz Rysunek 1.1 „Fazy materii”).
Fakt, że ta zapałka się pali jest właściwością chemiczną zapałki.

„zapalanie zapałki” (http://commons.wikimedia.org/wiki/File:Match_stick,_lit_a_match,_match_box,_fire.JPG) by Jith JR is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported.
Właściwości chemiczne to cechy materii, które opisują, jak materia zmienia postać w obecności innej materii. Czy próbka materii pali się? Spalanie jest właściwością chemiczną. Czy zachowuje się ona gwałtownie po włożeniu do wody? Ta reakcja również jest właściwością chemiczną (Rysunek 1.2 „Właściwości chemiczne”). W kolejnych rozdziałach zobaczymy, jak opisy właściwości fizycznych i chemicznych są ważnymi aspektami chemii.
Rysunek 1.3 Zmiany fizyczne
Stały lód topi się w ciekłą wodę – zmiana fizyczna.

„Melting Ice Cubes” (https://www.flickr.com/photos/jariceiii/5012344135/) by Jar is licensed under Creative Commons Attribution 2.0 Generic.
Gdyby materia zawsze pozostawała taka sama, chemia byłaby raczej nudna. Na szczęście, główna część chemii obejmuje zmiany. Zmiana fizyczna zachodzi, gdy próbka materii zmienia jedną lub więcej swoich właściwości fizycznych. Na przykład, ciało stałe może się stopić (Rysunek 1.3 „Zmiany fizyczne”), lub alkohol w termometrze może zmienić objętość wraz ze zmianą temperatury. Zmiana fizyczna nie ma wpływu na skład chemiczny materii.
Zmiana chemiczna to proces wykazywania właściwości chemicznych, takich jak paląca się zapałka na Rysunku 1.2 „Właściwości chemiczne”. Gdy materia w zapałce spala się, zmienia się jej skład chemiczny i powstają nowe formy materii o nowych właściwościach fizycznych. Zauważ, że zmianom chemicznym często towarzyszą zmiany fizyczne, ponieważ nowa materia będzie prawdopodobnie miała inne właściwości fizyczne niż materia pierwotna.
Przykład 2
Opisz każdy proces jako zmianę fizyczną lub zmianę chemiczną.
- Woda w powietrzu zamienia się w śnieg.
- Włosy człowieka zostają obcięte.
- Ciasto chlebowe staje się świeżym chlebem w piekarniku.
Rozwiązanie
- Ponieważ woda przechodzi z fazy gazowej do fazy stałej, jest to zmiana fizyczna.
- Twoje długie włosy zostają skrócone. To jest zmiana fizyczna.
- Ponieważ temperatura pieca, zmiany chemiczne zachodzą w cieście chlebowym, aby zrobić świeży chleb. Są to zmiany chemiczne. (W rzeczywistości, wiele procesów kulinarnych wiąże się ze zmianami chemicznymi.)
Sprawdź Siebie
Zidentyfikuj każdy proces jako zmianę fizyczną lub chemiczną.
- Ogień szaleje w kominku.
- Woda jest podgrzewana, aby zaparzyć filiżankę kawy.
Odpowiedzi
- zmiana chemiczna
- zmiana fizyczna
Próbka materii, która ma te same właściwości fizyczne i chemiczne w całym procesie nazywana jest substancją. Czasami używa się zwrotu czysta substancja, ale słowo czysta nie jest potrzebne. Definicja terminu substancja jest przykładem na to, że chemia ma określoną definicję słowa, które w języku potocznym jest używane z inną, niejasną definicją. Tutaj będziemy używać terminu substancja z jego ścisłą chemiczną definicją.
Chemia rozpoznaje dwa różne rodzaje substancji: pierwiastki i związki. Pierwiastek jest najprostszym rodzajem substancji chemicznej; nie można go rozłożyć na prostsze substancje chemiczne za pomocą zwykłych środków chemicznych. Nauce znanych jest około 115 pierwiastków, z których 80 jest stabilnych. (Pozostałe pierwiastki są radioaktywne, co rozważymy w rozdziale 15 „Chemia jądrowa”). Każdy pierwiastek ma swój własny, unikalny zestaw właściwości fizycznych i chemicznych. Przykłady pierwiastków to żelazo, węgiel i złoto.
Związek to połączenie więcej niż jednego pierwiastka. Fizyczne i chemiczne właściwości związku różnią się od fizycznych i chemicznych właściwości jego elementów składowych; to znaczy, że zachowuje się on jak zupełnie inna substancja. Znanych jest ponad 50 milionów związków chemicznych, a codziennie odkrywane są kolejne. Przykładami związków są woda, penicylina i chlorek sodu (chemiczna nazwa zwykłej soli kuchennej).
Pierwiastki i związki nie są jedynymi sposobami, w jakie może występować materia. Często spotykamy obiekty, które są fizycznymi kombinacjami więcej niż jednego pierwiastka lub związku. Fizyczne kombinacje więcej niż jednej substancji są nazywane mieszaninami. Istnieją dwa rodzaje mieszanin. Mieszanina heterogeniczna to mieszanina składająca się z dwóch lub więcej substancji. Łatwo jest stwierdzić, czasami gołym okiem, że obecna jest w niej więcej niż jedna substancja. Mieszanina homogeniczna to połączenie dwóch lub więcej substancji, które są tak dokładnie wymieszane, że zachowują się jak jedna substancja. Innym słowem określającym mieszaninę jednorodną jest roztwór. Tak więc połączenie soli i wełny stalowej jest mieszaniną heterogeniczną, ponieważ łatwo jest zauważyć, które cząsteczki materii są kryształkami soli, a które wełny stalowej. Z drugiej strony, jeśli weźmiemy kryształki soli i rozpuścimy je w wodzie, bardzo trudno jest stwierdzić, że mamy do czynienia z więcej niż jedną substancją tylko na podstawie wyglądu – nawet jeśli użyjemy potężnego mikroskopu. Sól rozpuszczona w wodzie jest mieszaniną homogeniczną, czyli roztworem (Rysunek 1.4 „Rodzaje mieszanin”).
Rysunek 1.4 Rodzaje mieszanin

Przykład 3
Identyfikuj następujące kombinacje jako mieszaniny heterogeniczne lub mieszaniny homogeniczne.
- woda sodowa (Dwutlenek węgla jest rozpuszczony w wodzie.)
- mieszanina opiłków żelaza i sproszkowanej siarki (Zarówno żelazo jak i siarka są pierwiastkami.)
Rozwiązanie
- Ponieważ dwutlenek węgla jest rozpuszczony w wodzie, możemy wnioskować z zachowania kryształów soli rozpuszczonych w wodzie, że dwutlenek węgla rozpuszczony w wodzie jest (również) mieszaniną jednorodną.
- Zakładając, że żelazo i siarka są po prostu zmieszane razem, powinno być łatwo zobaczyć, co jest żelazem, a co siarką, więc jest to mieszanina niejednorodna.
Sprawdź się
Czy poniższe połączenia są mieszaninami jednorodnymi czy niejednorodnymi?
- ciało ludzkie
- amalgamat, połączenie kilku innych metali rozpuszczonych w niewielkiej ilości rtęci
Odpowiedzi
- mieszanina heterogeniczna
- mieszanina homogeniczna
Istnieją inne deskryptory, których możemy użyć do opisania materii, zwłaszcza pierwiastków. Zazwyczaj możemy podzielić pierwiastki na metale i niemetale, a każdy zestaw dzieli pewne (ale nie zawsze wszystkie) właściwości. Metal to pierwiastek, który jest stały w temperaturze pokojowej (chociaż rtęć jest dobrze znanym wyjątkiem), jest błyszczący i srebrzysty, dobrze przewodzi elektryczność i ciepło, może być tłoczony w cienkie arkusze (właściwość zwana ciągliwością) i może być ciągnięty w cienkie druty (właściwość zwana plastycznością). Niemetal to pierwiastek, który jest kruchy w stanie stałym, niezbyt dobrze przewodzi prąd elektryczny i ciepło, i nie może być wytwarzany w postaci cienkich arkuszy lub drutów (Rysunek 1.5 „Półmetale”). Niemetale również występują w różnych fazach i kolorach w temperaturze pokojowej. Niektóre pierwiastki posiadają właściwości zarówno metali jak i niemetali i nazywane są półmetalami (lub metaloidami). Zobaczymy później, jak te opisy mogą być dość łatwo przypisane do różnych pierwiastków.
Rysunek 1.5 Semimetale

„Pouring liquid mercury bionerd” is licensed under the Creative CommonsAttribution 3.0 Unported; „Sulphur-vulcano” by Heidi Soosalu is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported.
Figura 1.6 „Opisywanie materii” to schemat blokowy zależności pomiędzy różnymi sposobami opisywania materii.
Figura 1.6 Opisywanie materii
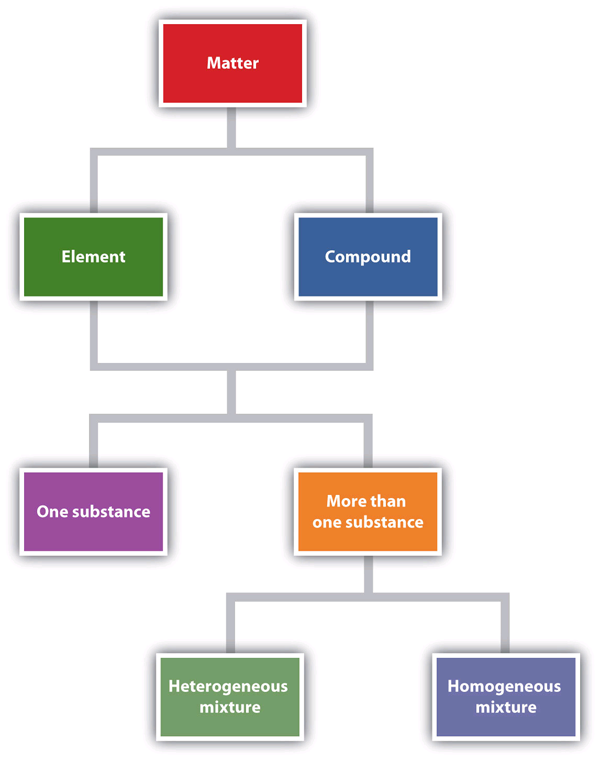
Ten schemat blokowy pokazuje, jak można opisać materię.
Chemia jest wszędzie: In the Morning
Większość ludzi ma swój poranny rytuał, proces, przez który przechodzą każdego ranka, aby przygotować się do dnia. Chemia pojawia się w wielu z tych czynności.
- Jeśli bierzesz prysznic lub kąpiel rano, prawdopodobnie używasz mydła, szamponu lub obu. Te przedmioty zawierają substancje chemiczne, które wchodzą w interakcję z olejem i brudem na twoim ciele i włosach, aby je usunąć i zmyć. Wiele z tych produktów zawiera również substancje chemiczne, które sprawiają, że ładnie pachniesz; nazywa się je substancjami zapachowymi.
- Gdy rano myjesz zęby, zazwyczaj używasz pasty do zębów, która jest formą mydła, do czyszczenia zębów. Pasty do zębów zazwyczaj zawierają małe, twarde cząsteczki zwane materiałami ściernymi, które fizycznie szorują zęby. Wiele past do zębów zawiera również fluor, substancję, która wchodzi w chemiczną interakcję z powierzchnią zębów, aby pomóc w zapobieganiu ubytkom.
- Pewnie codziennie rano zażywasz witaminy, suplementy lub leki. Witaminy i inne suplementy zawierają substancje chemiczne, których Twój organizm potrzebuje w niewielkich ilościach do prawidłowego funkcjonowania. Leki to substancje chemiczne, które pomagają zwalczać choroby i promować zdrowie.
- Pewnie robisz na śniadanie jajka sadzone. Smażenie jajek polega na podgrzaniu ich na tyle, że zachodzi reakcja chemiczna, aby ugotować jajka.
- Po jedzeniu, jedzenie w żołądku wchodzi w reakcję chemiczną, aby organizm (głównie jelita) mógł wchłonąć jedzenie, wodę i inne składniki odżywcze.
- Jeśli jedziesz samochodem lub autobusem do szkoły lub pracy, używasz pojazdu, który prawdopodobnie spala benzynę, materiał, który spala się dość łatwo i dostarcza energii do zasilania pojazdu. Przypomnij sobie, że spalanie jest zmianą chemiczną.
To tylko kilka przykładów na to, jak chemia wpływa na Twoje codzienne życie. A nie dotarliśmy jeszcze do lunchu!
Rysunek 1.7 Chemia w prawdziwym życiu

„Soaps and Shampoos” autorstwa Takashi Ota is licensed under Creative Commons Attribution 2.0 Generic; „English Breakfast” jest udostępnione na licencji Creative Commons Attribution-Share Alike 3.0 Unported; „Langley, Trans-Canada Highway” James jest udostępnione na licencji Creative Commons Attribution- Share Alike 3.0 Unported.

Źródło wideo: The chemical world by keyj (https://viuvideos.viu.ca/media/The+Chemical+World/0_ixlxmwe8)
Key Takeaways
- Chemia to nauka o materii i jej interakcjach z inną materią i energią.
- Materia to wszystko, co ma masę i zajmuje przestrzeń.
- Materię można opisać w kategoriach właściwości fizycznych i właściwości chemicznych.
- Właściwości fizyczne i chemiczne materii mogą się zmieniać.
- Materia składa się z pierwiastków i związków.
- Połączenia różnych substancji nazywane są mieszaninami.
- Pierwiastki mogą być opisane jako metale, niemetale i półmetale.
Ćwiczenia
- Zidentyfikuj każdy z nich jako materię lub nie materię.
a) książka
b) nienawiść
c) światło
d) samochód
e) jajko sadzone
2. Podaj przykład materii w każdej z faz: stałej, ciekłej lub gazowej.
3. Czy każde stwierdzenie reprezentuje właściwość fizyczną czy chemiczną?
a) Siarka jest żółta.
b) Wełna stalowa pali się po zapaleniu płomieniem.
c) Galon mleka waży ponad osiem funtów.
4. Czy każde stwierdzenie reprezentuje właściwość fizyczną czy chemiczną?
a) Sterta liści powoli gnije na podwórku.
b) W obecności tlenu wodór może oddziaływać, tworząc wodę.
c) Złoto można rozciągnąć na bardzo cienkie druty.
5. Czy każde stwierdzenie reprezentuje zmianę fizyczną czy chemiczną?
a) Woda wrze i staje się parą.
b) Żywność jest przekształcana w formę użytkową przez system trawienny.
c) Alkohol w wielu termometrach zamarza przy około -40 stopniach Fahrenheita.
6. Czy każde stwierdzenie reprezentuje zmianę fizyczną czy chemiczną?
a) Grafit, forma węgla pierwiastkowego, może zostać przekształcony w diament, inną formę węgla, w bardzo wysokiej temperaturze i pod bardzo wysokim ciśnieniem.
b) Dom po drugiej stronie ulicy został pomalowany na nowy kolor.
c) Pierwiastki sód i chlor łączą się, tworząc nową substancję zwaną chlorkiem sodu.
7. Rozróżnij pierwiastek i związek. Jaka jest liczba każdego z nich?
8. Jaka jest różnica między mieszaniną jednorodną a mieszaniną niejednorodną?
9. Zidentyfikuj każdą z nich jako mieszaninę heterogeniczną lub mieszaninę jednorodną.
a) Sól miesza się z pieprzem.
b) Cukier rozpuszcza się w wodzie.
c) Makaron gotuje się we wrzącej wodzie.
10. Zidentyfikuj każdą z nich jako mieszaninę niejednorodną lub mieszaninę jednorodną.
a) powietrze
b) brud
c) telewizor
11. W ćwiczeniu 9, które wybory są jednocześnie rozwiązaniami?
12. W ćwiczeniu 10, które wybory są również rozwiązaniami?
13. Dlaczego żelazo zaliczane jest do metali?
14. Dlaczego tlen jest uważany za niemetal?
15. Rozróżnij metal od niemetalu.
16. Jakie właściwości mają półmetale?
17. Węgiel pierwiastkowy jest czarnym, matowym ciałem stałym, które dobrze przewodzi ciepło i elektryczność. Jest bardzo kruchy i nie można go wytworzyć w postaci cienkich arkuszy lub długich drutów. Z tych właściwości, jak węgiel zachowuje się jako metal? Jak zachowuje się węgiel jako niemetal?
18. Czysty krzem jest błyszczący i srebrzysty, ale nie przewodzi dobrze elektryczności ani ciepła. Z tych właściwości, jak zachowuje się krzem jako metal? Jak zachowuje się krzem jako niemetal?
Odpowiedzi
a) materia
b) nie materia
c) nie materia
d) materia
a) właściwość fizyczna
b) właściwość chemiczna
c) właściwość chemiczna
d) właściwość chemiczna właściwość
c) właściwość fizyczna
a) zmiana fizyczna
b) zmiana chemiczna
c) zmiana fizyczna
7. Pierwiastek to podstawowa część chemiczna substancji; znanych jest około 115 pierwiastków. Związek to połączenie pierwiastków, które zachowuje się jak inna substancja; znanych jest ponad 50 milionów substancji.
a) niejednorodne
b) jednorodne
c) niejednorodne
11. Wybór b jest roztworem.
13. Żelazo jest metalem, ponieważ ma postać stałą, jest błyszczące i dobrze przewodzi prąd i ciepło.
15. Metale są zazwyczaj błyszczące, dobrze przewodzą elektryczność i ciepło oraz są ciągliwe i plastyczne; niemetale mają różne kolory i fazy, są kruche w fazie stałej i nie przewodzą dobrze ciepła ani elektryczności.
17. Węgiel zachowuje się jak metal, ponieważ dobrze przewodzi ciepło i elektryczność. Jest niemetalem, ponieważ jest czarny i kruchy i nie może być wytwarzany w postaci arkuszy lub drutów.